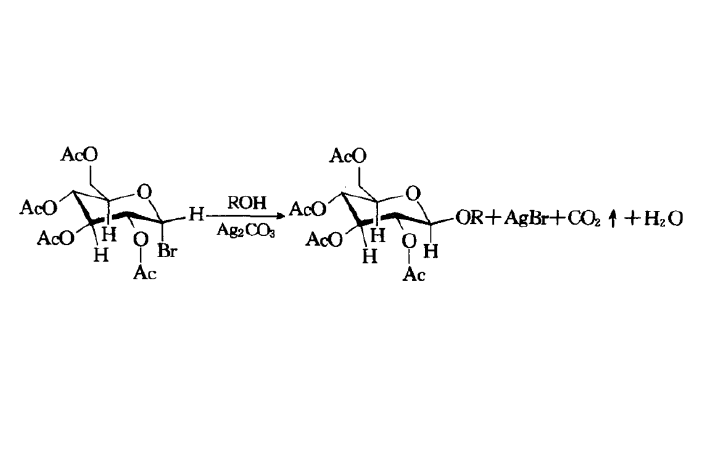
反應機理
由於此反應的高非對映立體選擇性,親核試劑的進攻應該遵循SN2機理,而且2位的乙醯基有鄰基參與效應,形成了一個二氧烷基鎓離子和氧羰基鎓離子互變的中間體。
SN2反應最常發生在
脂肪族sp3
雜化的碳原子上,碳原子與一個
電負性強、穩定的
離去基團(-X)相連,一般為
鹵素陰離子。
親核試劑(Nu)從離去基團的正後方進攻碳原子,Nu-C-X角度為180°,以使其
孤對電子與C-X鍵的σ反鍵軌道可以達到最大重疊。然後形成一個五配位的反應
過渡態,碳約為sp2雜化,用兩個垂直於平面的
p軌道分別與離去基團和親核試劑成鍵。C-X的斷裂與新的C-Nu鍵的形成是同時的,-X很快離去,形成含C-Nu鍵的新化合物。SN2反應一般發生在伯碳原子上,很難成為有
位阻分子的反應機理,並且
取代基越多,按SN2機理反應的可能性越小。基團在空間上比較擁擠的分子一般採用
SN1機理,可以緩解一部分的位阻,也可生成較穩定的
碳正離子(通常為三級碳正離子)。由於
親核試劑是從
離去基團的背面進攻,故如果受進攻的原子具有
手性,則反應後手性原子的
立體化學發生構型翻轉,也稱“瓦爾登翻轉”。這也是SN2反應在立體化學上的重要特徵。反應過程類似於大風將雨傘由里向外翻轉。
鄰基參與效應,有機化學概念之一,指的是相鄰基團含有的σ鍵、π鍵電子或孤對電子與反應中心發生作用,使反應的某些性質發生改變的現象。鄰近基團參與,簡稱鄰基參與(neighboringgroupparticipation,NGP)是飽和碳原子上親核取代反應中一種常見現象,鄰基參與效應不僅能導致反應速度的加快和重排的發生,而且還可控制反應的立體化學,因而在有機合成中得到廣泛套用。能夠產生鄰基參與效應的基團通常含有帶孤對電子的原子(如氧、硫、氮和鹵原子等),或是具有π電子的基團(如苯環、碳碳雙鍵等)。這些具有孤對電子或π電子的基團在反應過程中能夠作為親核試劑優先發生分子內的親核取代,形成的不穩定環狀中間體再接受親核試劑的進攻,得到穩定的取代產物。
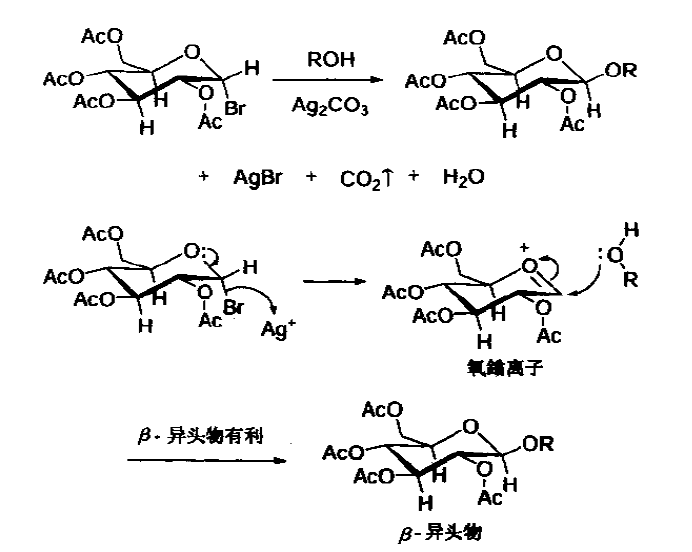 反應機理
反應機理反應特點
1)糖基鹵化物可以利用鹵化試劑鹵化異頭碳上的羥基得到;2)各種糖基鹵化物的反應活性和穩定各不同,主要和鹵原子的種類和糖環上的取代基的種類有關:氯比溴穩定,但碘代物通常很不穩,糖環上的吸電子取代基會增加其穩定性;3)糖基鹵化物的反應活性還和反應的溶劑,溫度和一些輔助試劑(路易斯酸和重金屬鹽)有關;4)反應具有立體定向性,取代總是發生在異頭碳(C1)上,因此具有很高的非對映立體選擇性;5)當鄰基參與不能進行時(如R4=O-alkyl),受端基異構效應的影響形成α-O-糖;6)當可以進行鄰基參與時(如R4=O-acyl),可以由α-糖基鹵化物得到β-O-糖;7)反應輔助試劑或催化劑通常是溶於非質子性溶劑中的銀鹽或汞鹽,反應副產物酸通常用一些鹼(如碳酸銀,三甲基吡啶)中和;8)由於糖基鹵化物的熱力學穩定性很差,因此反應通常在室溫或低於室溫下進行。
反應缺點
1)糖基鹵化物對熱不穩定,製備的條件比較苛刻;2)糖基鹵化物可以發生水解或1,2-消除;3)反應的輔助試劑通常需要等摩爾量加入,並且它們通常是有毒的或具有爆炸性。
反應舉例
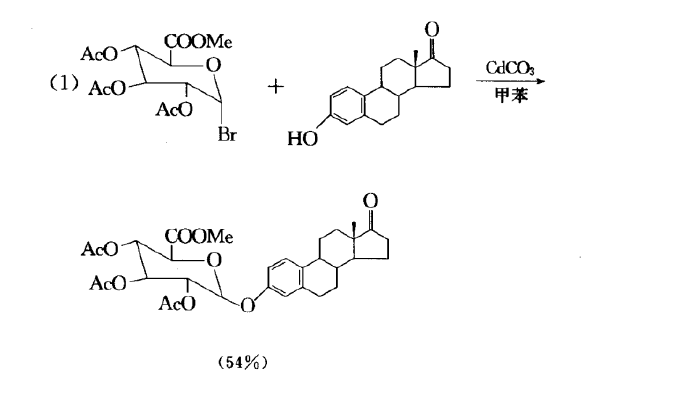 反應舉例
反應舉例 反應機理
反應機理 反應舉例
反應舉例