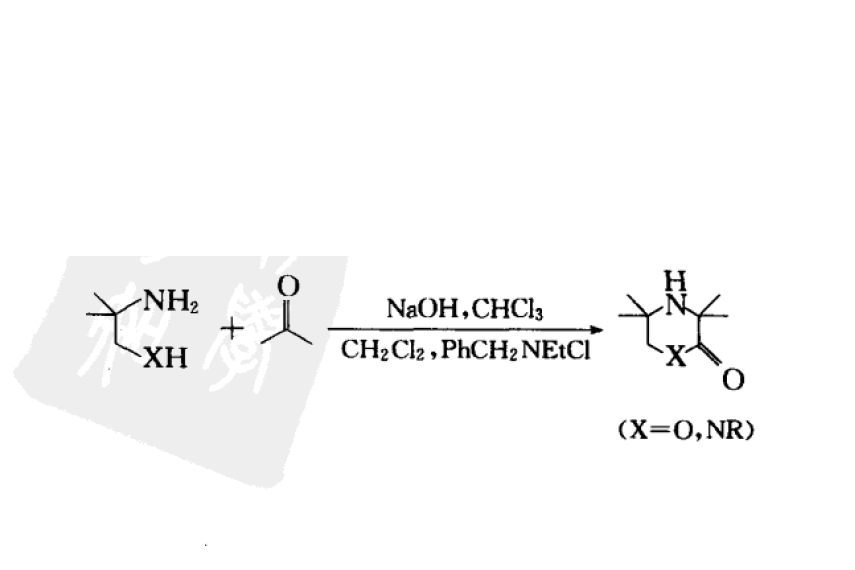
2-氨基-2-甲基丙醇或1,2-二氨基丙烷與丙酮反應合成有位阻嗎啉酮和哌嗪酮。
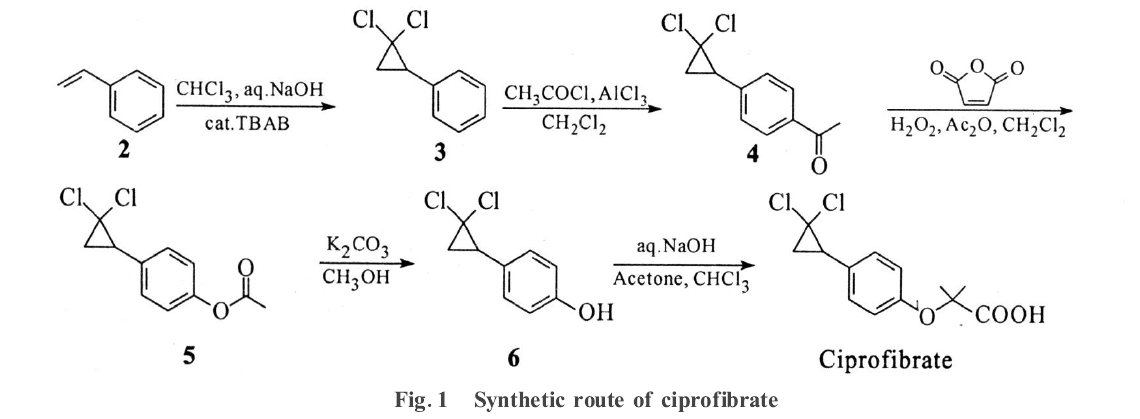
以廉價苯乙烯為起始原料,依次經成環、Friedel-Crafts醯化、Baeyer-Villiger重排、醇解、Bargellini反應,成功合成了環丙貝特。
基本介紹
- 中文名:Bargellini重排
- 產物:有位阻嗎啉酮和哌嗪酮
- 重要產物:環丙貝特
- 領域:有機合成
反應機理,反應舉例,環丙貝特的合成,
反應機理
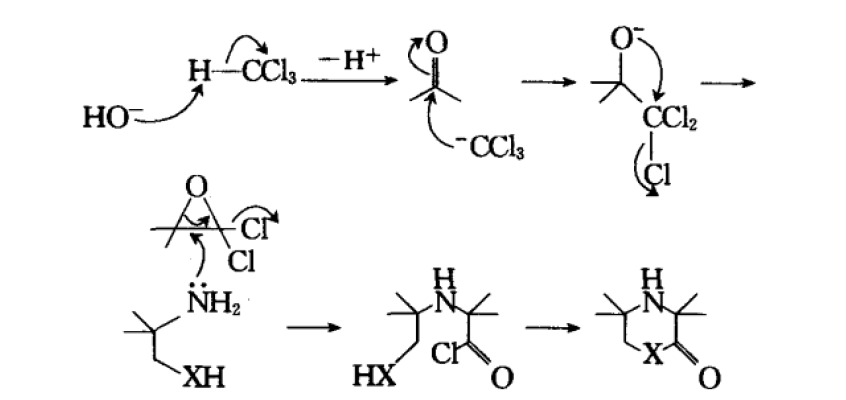 反應機理
反應機理反應舉例
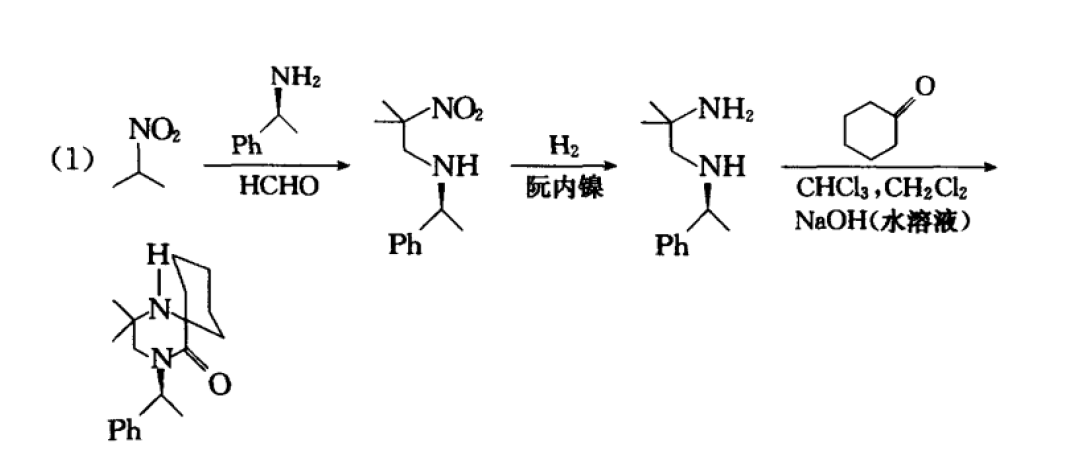 反應舉例
反應舉例環丙貝特的合成
環丙貝特是苯氧乙酸類降血脂藥,化學名為2-[4-(2,2-二氯環丙基)苯氧基]-2-甲基丙酸。文獻是以化合物3為起始原料,經Friedel-Crafts醯化後,與過氧酸作用進行Baeyer-Villiger重排,得酚酯。5醇解後得酚類化合物6,再與α-溴代異丁酸酯反應,製得環丙貝特。以廉價的苯乙烯為起始原料,經成環、Friedel-Crafts醯化後生成酮類化合物4。針對Baeyer-Villiger重排反應。
 反應過程
反應過程工業生產時若直接使用過氧酸比較危險,故採用馬來酸酐、乙酸酐和體積分數為30%的過氧化氫混和原位生成過氧酸,再與化合物4作用發生Baeyer-Villiger重排生成酚酯,大大提高了操作的安全性。由於α-溴代異丁酸酯較昂貴,為降低合成成本,將化合物6在鹼性條件下與丙酮和氯仿作用,發生Bargellini反應,得環丙貝特。
1、1-苯基-2,2-二氯環丙烷(3)的製備
40℃條件下,將苯乙烯(57.3 mL,0.50 mol)、四丁基溴化銨(3.2 g,0.01 mol)、氫氧化鈉(50.0 g,1.25 mol)、水(50 mL)與氯仿(83.5 mL)的混和物,攪拌反應5 h。待反應結束後,加入飽和氯化鈉溶液(150 mL),氯仿萃取(200 mL×3次),合併有機層,無水硫酸鈉乾燥。濃縮後減壓蒸餾,得無色液體(化合物3)89.6 g,收率95.8%。
2、4-(2,2-二氯環丙基)苯乙酮的製備
在0℃、氬氣保護下,將乙醯氯(42.6 mL,0.6 mol)緩慢滴至二氯甲烷(300 mL)與無水三氯化鋁(76.0 g,0.57 mol)的混和液中,攪拌20 min後,繼續控溫並將化合物3(93.54 g,0.5 mol)緩慢滴入其中。加畢,自然升溫至20℃,並繼續攪拌反應3h。加入冰水(500 mL)。分取有機層,飽和氯化鈉溶液(400mL×3)洗,無水硫酸鈉乾燥。濃縮,減壓蒸餾,得淡黃色黏稠液體(化合物4)100.5 g,收率87.7%。
3、4-(2,2-二氯環丙基)苯氧基乙酸酯的製備
20℃時,將體積分數為30%的過氧化氫(90 mL,0.8 mol)緩慢滴至順丁烯二酸酐(58.8 g,0.6 mol)與二氯甲烷(100 mL)的混和液中,繼續攪拌1 h後,再緩慢滴入乙酸酐(380 mL,4 mol)。加畢,將溫度緩慢升至30℃,再攪拌1 h。最後緩慢滴加化合物4(45.8 g,0.2 mol),溫度升至40℃反應8 h。冷卻,分取有機層,1.0 mol·L-1亞硫酸鈉溶液(60 mL)與10 mol·L-1氫氧化鈉溶液(50mL)的混和液洗滌3次,無水硫酸鈉乾燥。濃縮,殘餘物以正己烷重結晶,得白色固體(化合物5)44.6g,收率91.0%。
4、4-(2,2-二氯環丙基)苯酚的製備
35℃時,將化合物5(49.0g,0.2mol)、碳酸鉀(2.0g,0.014mol)和甲醇(100mL)的混和物一起攪拌反應3h,濃縮,得黃色固體(化合物6)備用。
5、2-[4-(2,2-二氯環丙基)苯氧基]-2-甲基丙酸的製備
0℃時,將氫氧化鈉(40.0g,1.0mol)緩慢加至上步所得化合物6(以0.2mol計)與丙酮(19.5mL,0.24mol)的混和液中,邊加邊攪拌直至溶解。然後緩慢滴加氯仿(200mL),並逐漸升溫回流2h。濃縮後,加入水(100mL),以2.0mol·L-1鹽酸調pH2,乙酸乙酯(300mL×3)萃取,合併有機相,無水硫酸鈉乾燥。濃縮,以正己烷重結晶,得白色目標物(化合物1)42.6g,2步反應收率73.6%。