ACF圖解(ACF diagram)是表示變質相中含石英變質岩的礦物共生組合與岩石化學成分之間相互關係的一種三元系圖解。
基本介紹
- 中文名:ACF圖解
- 外文名:ACF diagram
- 表示:成分範圍廣泛的含石英變質岩
- 特點:一般用等邊三角形表示
介紹,組分分析,ACF圖編制,岩石成分標繪,
介紹
Eskola(1915) 設計ACF 圖以表示成分範圍廣泛的含石英變質岩(包括泥質、長英質、基性、鈣質、鎂質)的礦物共生。
一般用等邊三角形表示,三角形的三個頂點分別為A、C、F,其中A=Al2O3+Fe2O3-(Na2O+K2O),C=CaO,F=FeO+MgO+MnO。各種氧化物的數量均用分子數表示,將A、C、F的分子數換算成各自所占百分數,並使A+C+F=100。ACF圖解的優點是能表示各種原岩成分與變質礦物組合之間的關係,尤其是變質泥質岩和變質基性岩的礦物共生組合。
組分分析
對普通的含石英變質岩,不考慮微量組分和孤立組分,通常包括SiO 2 、Al 2 O 3 、Fe 2 O 3 、FeO、MnO、MgO、CaO、Na 2 O、K 2 O、CO 2 、H 2 O 等11 個組分,這些組分按其化學特徵和對礦物共生的影響可分為:
(1)完全活動組分:H 2 O、CO 2 (Eskola 把它們處理為過剩組分)。共生圖解中不予考慮。
(2)過剩組分:SiO 2 。共生圖解中不予考慮,把過剩礦物Q 放在圖解之外。
(3)類質同象組分:岩石中存在兩種類質同象。一類是Al 2 O 3與Fe 2 O 3類質同象和FeO、MnO、MgO 類質同象,它們普遍出現在造岩礦物中,因而將它們合併處理為兩個獨立組分:(Al,Fe) 2 O 3和(Fe, Mg, Mn)O。如前所述,這種處理有不合理之處;另一類是Na 2 O 與CaO類質同象,僅出現在斜長石中,而不出現在其他含鈣礦物中。因此,不能將它們合併。Eskola的處理辦法是:由於Na 2 O 只在斜長石中作為CaO 的類質同象組分出現,其含量多少有無,只影響斜長石號碼,而不會增加或減少一個礦物相。因此,Na 2 O 不是獨立組分,可不予以考慮,把鈉長石放在圖解之外。
(4)有效惰性組分:經過上述組分分析後,得出4 個有效惰性組分,即(Al,Fe) 2 O 3 、CaO、K 2 O、(Fe,Mg,Mn)O。為了把組分數減至3,以便於圖解表示,Eskola 把K 2 O 作為過剩組分,不予以考慮,把鉀長石放在圖解之外。這樣一來,使得該圖解出現一個明顯的缺點:區分不了低溫下泥質變質岩中K 2 O過剩與K 2 O 不足的兩類組合。
ACF圖編制
Eskola(1939)將上述三個有效惰性組分為頂點的成分-共生圖解命名為ACF 圖(ACFdiagram)。其中:
A=[Al 2 O 3 ]+[Fe 2 O 3 ]
C=[CaO]
F=[FeO]+[MgO]+[MnO]
A+C+F=100.
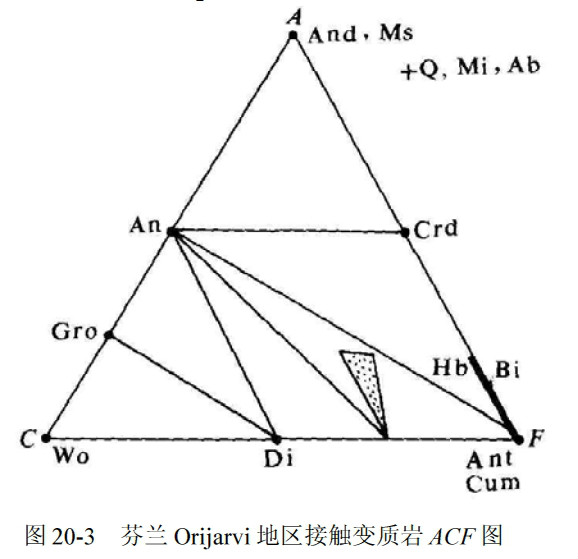
在三角形圖解上,按礦物組成的ACF比值標繪礦物後,按礦物的實際共生關係連線共生線即完成了ACF 圖解,如圖20-3。
將礦物化學式寫成氧化物形式,易於計算礦物的ACF 值,從而便於標繪礦物。例如:
And(紅柱石)Al 2 O 3 ·SiO 2 A=100
Crd(堇青石)2(Mg, Fe)O·2Al 2 O 3 ·5SiO 2 A=50, F=50
An(鈣長石)CaO·Al 2 O 3 ·2SiO 2 A=50, C=50
Di(透輝石)CaO·(Mg, Fe)O·2SiO 2 C=50, F=50
Gro(鈣鋁榴石)3CaO·Al 2 O 3 ·3SiO 2 A=25, C=75
Wo(矽灰石)CaO·SiO 2 C=100
顯然,圖20-3 使Orijarvi 地區接觸變質岩的礦物共生組合一目了然,這是圖解表示法的長處。對ACF 圖有兩點必須注意:一是圖中An 位置實際上並不是鈣長石,它與圖解外的Ab 一起代表某一號碼的斜長石;二是Ms(白雲母)、Bi(黑雲母)都是含鉀礦物,它們在共生組合中是否出現在很大程度上受岩石的K 2 O 組分控制,圖20-3 中所有組合都可出現Ms、Bi。ACF 圖不能表示K 2 O 對礦物共生的影響,因而,嚴格說來,它們不應該表示在ACF 圖上。
 ACF
ACF岩石成分標繪
如前所述,將岩石的組成標繪在成分-共生圖解上,可以預測該岩石的礦物共生組合。然而,由於在編制ACF 圖過程中,未考慮鉀長石、鈉長石和副礦物,因此,在根據岩石化學分析資料於ACF 圖上標繪岩石時,需從化學分析中扣除包含在這些礦物中的(Al,Fe) 2 O 3 、CaO、(Fe,Mg)O 的量。按照Eskola 方法,計算岩石的ACF 值的程式如下:
(1)用副礦物含量校正岩石化學分析:
為此,必須根據薄片(或X-射線物相分析)測定副礦物鈦鐵礦、磁鐵礦、赤鐵礦、黃鐵礦、榍石的實際含量(體積%),並將測定礦物的體積%轉換成w B %;w B %=相對密度×體積%。換算時可使用下列礦物相對密度值:磁鐵礦5.2,榍石3.5,鈦鐵礦4.7,黃鐵礦5.0,赤鐵礦5.1。然後,對岩石化學分析作下列校正:
因為鈦鐵礦中含有47.3% 的FeO 和52.7%的TiO 2 ,磁鐵礦含有31.0%的FeO 和69.0 的Fe 2 O 3 ,黃鐵礦含有53.4%的S 和46.6%的鐵,將黃鐵礦中的鐵換算成FeO,即一份黃鐵礦含有相當於46.6×71.8/55.8=60.0 的FeO,所以要:
從FeOw B %中減去鈦鐵礦w B %的50%,減去磁鐵礦w B %的30%,減去黃鐵礦w B %的60%;
從Fe 2 O 3 w B % 中減去磁鐵礦w B %的70%,減去赤鐵礦w B %的100%;
由於榍石中含有28.6 w B %的CaO、40.8 w B %的TiO 2和30.6 w B %的SiO 2 ,所以要:
從CaO w B %中減去榍石w B %的30%。
(2)把校正過的岩石化學分析的各個氧化物w B %(可不考慮SiO 2和H 2 O)除以其分子量再乘以1000,換算成氧化物的摩爾數。如:[CaO]=CaO w B %×1000/CaO 分子量。
假定岩石所有的K 2 O、Na 2 O 均組成鉀長石和斜長石的鈉長石分子。由於在鉀長石中,[K 2 O]=[Al 2 O 3 ],鈉長石中[Na 2 O]=[Al 2 O 3 ],因此,要在岩石的[Al 2 O 3 ]中扣除鉀長石、鈉長石中的[Al 2 O 3 ],只須在[Al 2 O 3 ]中減去([K 2 O] +[Na 2 O])即可。同樣,磷灰石的化學式為9CaO·3P 2 O 5 ·CaF 2,所以,磷灰石的[CaO]=3.3[P 2 O 5 ];方解石化學式為CaO·CO 2 ,所以,方解石的[CaO]=[CO 2 ]。為了扣除岩石中含在少量磷灰石和方解石中的[CaO] ,只須從岩石的[CaO]中減去(3.3[P 2 O 5 ] +[CO 2 ])(注意:鈣質變質岩不作此項校正)。
這樣,可把對副礦物作了必要校正後岩石的ACF 值計算方案總結如下:
A=[Al 2 O 3 ]+[Fe 2 O 3 ]-([Na 2 O] +[K 2 O])
C=[CaO]-(3.3[P 2 O 5 ] +[CO 2 ])
F=[FeO]+[MgO] +[MnO]
為了用圖解表示,要把這些值換算為A+C+F=100,即用摩爾百分數表示。

