鹽酸左西替利嗪口服溶液,適應症為蕁麻疹、過敏性鼻炎、濕疹、皮炎、皮膚瘙癢症等。
基本介紹
- 藥品名稱:鹽酸左西替利嗪口服溶液
- 藥品類型:處方藥、醫保工傷用藥
- 用途分類:哌嗪類
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,
成份
本品主要成份為鹽酸左西替利嗪
其化學名稱為(R)-(-)-2-[2-(4-(4-氯苯基)苯甲基)-1-哌嗪基)乙氧基]乙酸·二鹽酸鹽。
化學結構式:
其化學名稱為(R)-(-)-2-[2-(4-(4-氯苯基)苯甲基)-1-哌嗪基)乙氧基]乙酸·二鹽酸鹽。
化學結構式:
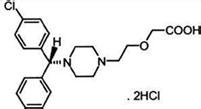
分子式:C21H25ClN2O3.2HCl
分子量:461.81
性狀
本品為無色澄清粘稠液體,味甜
適應症
蕁麻疹、過敏性鼻炎、濕疹、皮炎、皮膚瘙癢症等。
規格
0.05%
用法用量
用量:口服,成人及6歲以上兒童,一日一次,每次10ml(1支)。
2~6歲兒童,一日一次,每次5ml(0.5支)。
使用方法:於餐前半小時服用
2~6歲兒童,一日一次,每次5ml(0.5支)。
使用方法:於餐前半小時服用
不良反應
本品耐受性良好,不良反應輕微且多可自愈,常見不良反應有嗜睡、口乾、頭痛、乏力等。
禁忌
對本品及其他輔料過敏者禁用。
注意事項
1.有肝功能障礙或障礙史者慎用。
2.高空作業、駕駛或操縱機器期間慎用。
3.避免與鎮靜劑同服。
4.酒後避免使用本品。
5.腎功能減損患者使用本品適當減量。
2.高空作業、駕駛或操縱機器期間慎用。
3.避免與鎮靜劑同服。
4.酒後避免使用本品。
5.腎功能減損患者使用本品適當減量。
孕婦及哺乳期婦女用藥
孕期及哺乳期婦女禁用本品。
兒童用藥
2周歲以下兒童用藥的安全性尚未確定。
老年用藥
通常老年人生理機能衰退,需慎用本品。
藥物相互作用
尚無使用本品進行藥物相互作用的研究,消旋西替利嗪與偽麻黃鹼、西咪替丁、酮康唑、紅黴素、阿奇黴素、格列吡嗪和安定間無相互作用。
藥物過量
本品無特效拮抗劑,嚴重超量服用本品應立即洗胃。
藥理毒理
藥理作用:
本品為口服選擇性組胺H1受體拮抗劑。無明顯抗膽鹼和抗5-羥色胺作用,中樞抑制作用較小。
遺傳毒性:本品Ames試驗、人淋巴細胞染色體畸變試驗、小鼠淋巴瘤試驗和大鼠微核試驗結果均為陰性。
生殖毒性:
小鼠生育力和一般生殖毒性試驗結果提示,西替利嗪經口給藥劑量達64mg/kg(按體表面積折算,約相當於成人臨床推薦最人日口服劑量的25倍)時,對生育力無損傷。
小鼠、大鼠和兔經口給藥劑量分別達96、225和135mg/kg(按體表面積折算,分別約相當於成人臨床推薦最大日口服劑量的40、180和220倍)時,均未見致畸作用。但目前尚無充分和嚴格控制的孕婦臨床研究資料。由於動物生殖研究並不總能預測藥物對人的影響,所以只有當確實需要時,才可以在懷孕期間服用本品。
哺乳期小鼠(母鼠)經口給藥劑量達96mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的40倍)時,可引起仔鼠體重增長延遲。Beagie犬的研究表明,給藥量的大約3%經乳汁排泄。
致癌性:
大鼠連續2年經口給藥的致癌性試驗中,劑量達20mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的15倍,或兒童臨床推薦最大日劑量的10倍)時,未見致癌性。小鼠連續2年經口給藥的致癌性試驗中,劑量達16mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的6倍,或兒童臨床推薦最大日劑量的4倍)時,可引起雄性動物良性肝腫瘤的發生率增加;劑量為4mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的2倍,或兒童臨床推薦最大日劑量)時,未見肝腫瘤發生率的增加。上述發現的臨床意義尚不清楚。
本品為口服選擇性組胺H1受體拮抗劑。無明顯抗膽鹼和抗5-羥色胺作用,中樞抑制作用較小。
遺傳毒性:本品Ames試驗、人淋巴細胞染色體畸變試驗、小鼠淋巴瘤試驗和大鼠微核試驗結果均為陰性。
生殖毒性:
小鼠生育力和一般生殖毒性試驗結果提示,西替利嗪經口給藥劑量達64mg/kg(按體表面積折算,約相當於成人臨床推薦最人日口服劑量的25倍)時,對生育力無損傷。
小鼠、大鼠和兔經口給藥劑量分別達96、225和135mg/kg(按體表面積折算,分別約相當於成人臨床推薦最大日口服劑量的40、180和220倍)時,均未見致畸作用。但目前尚無充分和嚴格控制的孕婦臨床研究資料。由於動物生殖研究並不總能預測藥物對人的影響,所以只有當確實需要時,才可以在懷孕期間服用本品。
哺乳期小鼠(母鼠)經口給藥劑量達96mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的40倍)時,可引起仔鼠體重增長延遲。Beagie犬的研究表明,給藥量的大約3%經乳汁排泄。
致癌性:
大鼠連續2年經口給藥的致癌性試驗中,劑量達20mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的15倍,或兒童臨床推薦最大日劑量的10倍)時,未見致癌性。小鼠連續2年經口給藥的致癌性試驗中,劑量達16mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的6倍,或兒童臨床推薦最大日劑量的4倍)時,可引起雄性動物良性肝腫瘤的發生率增加;劑量為4mg/kg(按體表面積折算,約相當於成人臨床推薦最大日口服劑量的2倍,或兒童臨床推薦最大日劑量)時,未見肝腫瘤發生率的增加。上述發現的臨床意義尚不清楚。
藥代動力學
口服吸收迅速,達峰時間tmax=0.7~1小時,生物利用度>96%,與食物同服可使本品的達峰時間輕度延長,峰濃度降低(約20%)。1小時起效,療效可持續24小時。
本品的蛋白結合率為96%,平均表觀分布容積26.9L,在腦中的濃度低於血漿濃度的1/10,本品不經過肝臟代謝,消除半衰期7~8小時,絕大多數以原形藥物形式經腎臟排泄,尿中排泄量占85%,糞便中占13%。
本品的蛋白結合率為96%,平均表觀分布容積26.9L,在腦中的濃度低於血漿濃度的1/10,本品不經過肝臟代謝,消除半衰期7~8小時,絕大多數以原形藥物形式經腎臟排泄,尿中排泄量占85%,糞便中占13%。
貯藏
密封,置於陰涼(不超過20℃)處保存。
包裝
管制口服溶液瓶,10ml/支,6支/盒,8支/盒或10支/盒。
有效期
36個月
執行標準
國家藥品標準YBH04372005
