《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》是中國農業科學院飼料研究所於2011年4月1日申請的專利,該專利的公布號為CN102212508A,授權公布日為2011年10月12日,發明人是周志剛、張美超、曹雅男、何夙旭、毛瑋、張宇婷、霍鳳敏、徐俐。
《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》公開了一種高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用。該發明提供的蛋白質,是如下(a)或(b):(a)由序列表中序列1所示的胺基酸序列組成的蛋白質;(b)將序列1的胺基酸序列經過一個或幾個胺基酸殘基的取代和/或缺失和/或添加且具有N-醯基高絲氨酸內酯酶活性的由序列1衍生的蛋白質。該發明提供的AiiA-AIO6蛋白,是一種新的N-醯基高絲氨酸內酯酶,該酶比活力高、耐熱,具有較強的蛋白酶抗性和較好的降解各種底物的能力,可作為一種新型的生防酶製劑。
2020年7月14日,《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》獲得第二十一屆中國專利獎優秀獎。
基本介紹
- 中文名:高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用
- 申請人:中國農業科學院飼料研究所
- 申請日:2011年4月1日
- 申請號:2011100825655
- 公布號:CN102212508A
- 公布日:2011年10月12日
- 發明人:周志剛、張美超、曹雅男、何夙旭、毛瑋、張宇婷、霍鳳敏、徐俐
- 地址:北京市海淀區中關村南大街12號中國農業科學院飼料研究所
- Int. Cl.:C12N9/18(2006.01)I、C12N15/55(2006.01)I、C12N15/63(2006.01)I、C12N5/10(2006.01)I等;
- 代理機構:北京紀凱智慧財產權代理有限公司
- 代理人:關暢
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,附圖說明,權利要求,實施方式,榮譽表彰,
專利背景
群體感應(quorum sensing,QS)是細菌的一種調控機制,指細菌通過感應特定信號分子的濃度來感知周圍環境中自身或其它細菌的數量,並調整相關基因的表達以適應環境的變化,這些特定的信號分子(又稱為自誘導物)。
革蘭氏陰性細菌中典型的QS系統包括負責信號產生的luxI類基因、反應調節因子luxR類基因和LuxR蛋白結合區luxbox。革蘭氏陰性菌群體感應系統中最典型的一類信號分子是N-醯基-高絲氨酸內酯(N-acyl-homoserine lactones,AHLs)類化合物。細菌細胞通過產生AHLs進行信息交流,調控某些特定生理性狀的表達。
隨著對QS系統的深入研究,發現多種革蘭氏陰病原細菌的重要生理過程,包括毒性因子在內的次生代謝物的產生等均受QS系統的調控。如對人類主要條件致病菌銅綠假單胞菌晶片分析表明,在基因組中300多個基因受QS系統調控,其中包括了形成胞外蛋白酶、毒素和脂肪酶等致病因子表達的基因。再如引起植物軟腐病的重要致病菌胡蘿蔔果膠桿菌(Pectobacterium carotovorum)中,QS系統調控了包括合成和分泌能降解植物細胞壁的水解酶的表達及其它與寄主植物互作的毒性因子的產生。因此可以利用QS系統作為細菌病害防治的新靶點。
2011年前已將干擾QS系統中AHL信號分子的合成作為生物防治革蘭氏陰性病原菌的新靶標。而利用QS調控系統控制細菌病害的途徑之一是尋找能降解信號分子的酶,使AHL信號分子不能達到調控的臨界濃度以阻斷細菌間的信息交流從而防止病原菌的感染。2011年前已報導的N-醯基高絲氨酸內酯酶,比活力較低且耐熱性較差,限制了其套用價值。因此,發掘比活力更高、耐熱性更好的新酶,成為2011年前研究的一個重要方向。
發明內容
專利目的
《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》公開了一種高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用。
技術方案
《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》所提供的蛋白(AiiA-AIO6蛋白),來自蒼白桿菌(Ochrobactrum sp.),具有N-醯基高絲氨酸內酯酶功能,為如下(a)或(b)或(c):
(a)序列表中序列1自N末端第2至269位胺基酸殘基組成的蛋白質;
(b)由序列表中序列1所示的胺基酸序列組成的蛋白質;
(c)將序列1的胺基酸序列經過一個或幾個胺基酸殘基的取代和/或缺失和/或添加且具有N-醯基高絲氨酸內酯酶功能的由序列1衍生的蛋白質。
為了使(a)或(b)或(c)中的AiiA-AIO6蛋白便於純化,可在由序列表中序列1所示的胺基酸序列組成的蛋白質的氨基末端或羧基末端連線上如表1所示的標籤。
標籤 | 殘基數 | 序列 |
Poly-Arg | 5-6(通常為5個) | RRRRR |
Poly-His | 2-10(通常為6個) | HHHHHH |
FLAG | 8 | DYKDDDDK |
Strep-tag II | 8 | WSHPQFEK |
c-myc | 10 | EQKLISEEDL |
上述AiiA-AIO6蛋白可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述AiiA-AIO6蛋白的編碼基因可通過將序列表中序列2所示的DNA序列中缺失一個或幾個胺基酸殘基的密碼子,和/或進行一個或幾個鹼基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標籤的編碼序列得到。
編碼上述蛋白的基因(AiiA-AIO6基因)也屬於《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》的保護範圍。
所述基因可為如下1)或2)或3)或4)或5)的DNA分子:
1)序列表中序列2自5’末端第4至807位核苷酸所示的DNA分子;
2)序列表中序列2自5’末端第4至810位核苷酸所示的DNA分子;
3)序列表中序列2所示的DNA分子;
4)在嚴格條件下與1)或2)或3)限定的DNA序列雜交且編碼具有N-醯基高絲氨酸內酯酶活性的蛋白的DNA分子;
5)與1)或2)或3)限定的DNA序列具有90%以上同源性且編碼具有N-醯基高絲氨酸內酯酶活性的蛋白的DNA分子。
上述嚴格條件可為在6×SSC,0.5%SDS的溶液中,在65℃下雜交,然後用2×SSC,0.1% SDS 和1×SSC,0.1% SDS 各洗膜一次。含有以上任一所述基因的重組表達載體、表達盒、轉基因細胞系或重組菌均屬於《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》的保護範圍。
所述重組表達載體具體可為將所述基因插入載體pET-28a(+)的多克隆位點得到的重組質粒。所述重組菌具體可為將所述重組表達載體導入大腸桿菌得到的重組菌;所述大腸桿菌優選為大腸桿菌(Escherichia coli)BL21(DE3)。所述重組菌優選為大腸埃希氏菌(Escherichia coli)BL21pET28a(+)/aiia-AIO6,其保藏號為CGMCC No.4621。擴增所述基因全長或其任意片段的引物對也屬於《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》的保護範圍。所述蛋白可用於降解N-醯基高絲氨酸內酯。所述N-醯基高絲氨酸內酯具體可為C4-HSL、C6-HSL、C7-HSL、C8-HSL、C10-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C14-HSL、3-oxo-C10-HSL、3-hydroxy-C12-HSL和3-hydroxy-C14-HSL中的至少一種。所述降解的溫度可為0℃-50℃,優選為30℃。所述降解的pH值可為6.0-9.0,優選為8.0。
《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》提供的AiiA-AIO6蛋白,是一種新的N-醯基高絲氨酸內酯酶,該酶比活力高、耐熱,具有較強的蛋白酶抗性和較好的降解各種底物的能力,可作為一種新型的生防酶製劑。
附圖說明
圖1為AiiA-AIO6蛋白的SDS-PAGE分析。
圖2為標準曲線。
圖3為N-醯基高絲氨酸內酯酶AiiA-AO6的最適pH。
圖4為N-醯基高絲氨酸內酯酶AiiA-AO6的pH穩定性。
圖5為N-醯基高絲氨酸內酯酶AiiA-AO6作用的最適溫度。
圖6為N-醯基高絲氨酸內酯酶AiiA-AO6的熱穩定性。
圖7為N-醯基高絲氨酸內酯酶AiiA-AO6的蛋白酶抗性分析。
權利要求
1.一種蛋白質,為如下(a)或(b)或(c):
(a)序列表中序列1自N末端第2至269位胺基酸殘基組成的蛋白質;
(b)由序列表中序列1所示的胺基酸序列組成的蛋白質;
(c)將序列1的胺基酸序列經過一個或幾個胺基酸殘基的取代和/或缺失和/或添加且具有N-醯基高絲氨酸內酯酶功能的由序列1衍生的蛋白質。
2.編碼權利要求1所述蛋白的基因。
3.如權利要求2所述的基因,其特徵在於:它為如下1)或2)或3)或4)或5)的DNA分子:
1)序列表中序列2自5’末端第4至807位核苷酸所示的DNA分子;
2)序列表中序列2自5’末端第4至810位核苷酸所示的DNA分子;
3)序列表中序列2所示的DNA分子;
4)在嚴格條件下與1)或2)或3)限定的DNA序列雜交且編碼具有N-醯基高絲氨酸內酯酶活性的蛋白的DNA分子;
5)與1)或2)或3)限定的DNA序列具有90%以上同源性且編碼具有N-醯基高絲氨酸內酯酶活性的蛋白的DNA分子。
4.含有權利要求2或3所述基因的重組表達載體、表達盒、轉基因細胞系或重組菌。
5.如權利要求4所述的重組表達載體,其特徵在於:所述重組表達載體為將權利要求2或3所述基因插入載體pET-28a(+)的多克隆位點得到的重組質粒。
6.如權利要求4所述的重組菌,其特徵在於:所述重組菌為將權利要求4或5所述重組表達載體導入大腸桿菌得到的重組菌;所述大腸桿菌優選為大腸桿菌(Escherichia coli)BL21(DE3)。
7.如權利要求6所述的重組菌,其特徵在於:所述重組菌為大腸埃希氏菌(Escherichia coli)BL21pET28a(+)/aiia-AIO6,其保藏號為CGMCC No.4621。。
8.擴增權利要求2或3所述基因全長或其任意片段的引物對。
9.權利要求1所述蛋白在降解N-醯基高絲氨酸內酯中的套用。
10.根據權利要求8所述的套用,其特徵在於:所述N-醯基高絲氨酸內酯為C4-HSL、C6-HSL、C7-HSL、C8-HSL、C 10-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C14-HSL、3-oxo-C10-HSL、3-hydroxy-C12-HSL和3-hydroxy-C14-HSL中的至少一種;所述降解的溫度為0℃-50℃,優選為30℃;所述降解的pH值為6.0-9.0,優選為8.0。
實施方式
下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的試驗材料,如無特殊說明,均為自常規生化試劑商店購買得到的。以下實施例中的定量試驗,均設定三次重複實驗,結果取平均值。載體pEASY-T3購自北京全式金生物技術有限公司。大腸桿菌(Escherichia coli)BL21(DE3),載體pET-28a(+)均購自於Invitrogen公司。內切酶購自TaKaRa公司。連線酶購自Invitrogen公司。胰蛋白酶(Trypsin)、α-糜蛋白酶(α-Chymotrypsin)、蛋白酶K(Proteinase K)、枯草桿菌蛋白酶A(Subtilisin A)、膠原蛋白酶(Collagenase)、牛血清白蛋白均為Sigma(USA)產品。
N-butyryl-L-homoserine lactone(C4-HSL)、
N-hexanoyl-L-homoserine lactone(C6-HSL)、
N-heptanoyl-L-homoserine lactone(C7-HSL)、
N-Octanoyl-L-homoserine lactone(C8-HSL)、
N-decanoyl-L-homoserine lactone(C10-HSL)、
N-dodecanoyl-L-homoserine lactone(C12-HSL)、
N-tetradecanoyl-L-homoserine lactone(C14-HSL)、
N-(3-Oxohexanoyl)-D-homoserine lactone(3-oxo-C6-HSL)、
N-(3-Oxooctanoyl)-L-homoserine lactone(3-oxo-C8-HSL)、
N-(3-Oxodecanoyl)-L-homoserine lactone(3-oxo-C10-HSL)、
N-3-oxo-dodecanoyl-L-homoserine lactone(3-oxo-C12-HSL)、
N-(3-Oxotetradecanoyl)-L-homoserine lactone(3-oxo-C14-HSL)、
N-(3-hydroxy)-dodecanoyl-homoserine lactone(3-hydroxy-C12-HSL)、
N-(3-Hydroxytetradecanoyl)-DL-homoserine lactone(3-hydroxy-C14-HSL)均購自Sigma(St.Louis,Mo,USA)。
LB培養基:溶劑為水;溶質及其濃度如下:1%(質量百分含量)蛋白腖、0.5%(質量百分含量)酵母提取物、1%(質量百分含量)NaCl。
ATmm培養基:KH2PO410.75克/升,NaOH1.76克/升,(NH4)2SO41.98克/升,MgSO4·7H2O0.15克/升,CaCl26.6毫克/升,FeSO4·7H2O 7.5毫克/升,MnSO4·H2O 1.2毫克/升,葡萄糖5克/升,瓊脂粉20克/升,用超純水定容至1升。
KYC55(Agrobacterium tumefaciens KYC55):公眾可從中國農業科學院飼料研究所獲得;參考文獻:Cho,K.,C.Fuqua,and S.C.Winans.1997.Transcriptional regulation and locations of Agrobacterium tumefaciens genes required for complete ca
實施例1、蒼白桿菌AIO6的分離與鑑定
一、菌的分離
將土壤樣品按1:10(土:水)用無菌水重懸,用無菌水稀釋至10後塗布於LB平板(塗加5微米 C6-HSL和3-oxo-C6-HSL),25℃培養5天后,將菌落挑至液體LB中25℃培養3天,10000轉離心1分鐘收集菌體,重懸於0.1摩爾/升 PBS緩衝液(pH 8.0),超音波破碎後12000轉離心5分鐘,收集上清檢測N-醯基高絲氨酸內酯酶酶活。得到一株有酶活菌株,將該菌株命名為AIO6。
二、鑑定
擴增菌株AIO6的16S rDNA,再測序,測序結果與Genbank資料庫中的核苷酸序列比對,證明菌株AIO6為蒼白桿菌(Ochrobactrum sp.),將其命名為蒼白桿菌AIO6。
三、蛋白及其編碼基因的發現
1、蒼白桿菌AIO6接菌至LB培養基中,30℃培養24小時。取1毫升菌液,10000轉離心2分鐘收集菌體。使用TIANamp Bacteria DNA Kit(Tiangen,Beijing,China)提取基因組DNA,-20℃保存備用。
2、PCR擴增
以步驟1提取的基因組DNA為模板,用AIO6-F和AIO6-R組成的引物對進行PCR擴增,得到PCR擴增產物。
AIO6-F:5′-AAATCCCATGAAATCGAGACCAGTC-3′;
AIO6-R:5′-GGCCGTGCAGTCGCGCATGAAA-3′。
PCR反應參數:95℃5分鐘;94℃30sec,59℃30sec,72℃1分鐘,30個循環;72℃10分鐘。
3、測序
將PCR擴增產物進行瓊脂糖電泳,回收800bp左右的條帶與載體pEASY-T3連線,得到重組質粒。重組質粒的測序結果表明,在載體pEASY-T3中插入了序列表的序列2自5’末端第4至807位核苷酸所示的DNA。
將序列表的序列1所示的蛋白質命名為AiiA-AIO6蛋白,由269個胺基酸殘基組成。AiiA-AIO6蛋白屬於N-醯基高絲氨酸內酯酶。將AiiA-AIO6蛋白的編碼基因命名為AiiA-AIO6基因,其開放閱讀框如序列表的序列2所示(810bp)。
實施例2、重組菌的製備
一、重組表達載體的構建
1、合成序列表的序列2所示的DNA(AiiA-AIO6基因)。
2、以步驟一合成的DNA為模板,用A6-F和A6-R組成的引物對(靶序列如序列表的序列3所示)進行PCR擴增,得到PCR擴增產物。
A6-F:5′-CGGAATTCAAATCCCATGAAATCGAGACCAGTC-3′(劃線部分為EcoR I酶切位點);
A6-R:5′-TTAAGCGGCCGCTCAGGCCGTGCAGTCG-3′(劃線部分為Not I酶切位點)。
2、用限制性內切酶EcoR I和Not I雙酶切步驟1的PCR擴增產物,回收酶切產物。
3、用限制性內切酶EcoR I和Not I雙酶切載體pET-28a(+),回收載體骨架(約5.4kp)。
4、將步驟2的酶切產物與步驟3的載體骨架連線,得到重組質粒pET28a(+)/aiia-AIO6。根據測序結果,對重組質粒pET28a(+)/aiia-AIO6的結構描述如下:在載體pET-28a(+)的EcoR I和Not I酶切位點之間插入了序列表的序列2自5’末端第4至810位核苷酸所示的DNA。
二、重組菌和對照菌的構建
用重組質粒pET28a(+)/aiia-AIO6熱擊轉化大腸桿菌(Escherichia coli)BL21(DE3),得到重組菌。
將重組菌中的一株命名為大腸埃希氏菌(Escherichia coli)BL21pET28a(+)/aiia-AIO6,已於2011年2月28日保藏於中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址:北京市朝陽區北辰西路1號院3號,中國科學院微生物研究所,郵編100101),保藏號為CGMCC No.4621。大腸埃希氏菌(Escherichia coli)BL21pET28a(+)/aiia-AIO6 CGMCC No.4621簡稱重組菌aiia-AIO6。
用載體pET-28a(+)熱擊轉化大腸桿菌(Escherichia coli)BL21(DE3),得到對照菌。
五、重組菌和對照菌的誘導、表達和純化
1、將重組菌aiia-AIO6接種於3毫升 LB培養液(含50微克/毫升的卡那黴素)中,37℃振盪培養過夜,得到過夜培養液。
2、取100微升過夜培養液接種至的20毫升 LB培養液(含50微克/毫升卡那黴素)中,37℃振盪培養約2-3小時(OD600達到0.6-0.8),然後加入終濃度1摩爾/升的IPTG(誘導劑),震盪培養(20℃、180轉、旋轉半徑1.3厘米)12小時,得到培養液。
3、將步驟2得到的培養液12,000轉離心5分鐘(離心半徑6厘米),分別收集上清和細胞沉澱。
4、將細胞沉澱用0.1摩爾/升 PBS緩衝液(pH8.0)重懸,超聲破碎後12,000轉離心10分鐘(離心半徑6厘米),收集上清。
5、將步驟4得到的上清進行親和層析
層析柱的內徑為1.4厘米,長度為1厘米,體積為1.5立方厘米。Ni-NTA Agarose,Cat.NO.30210,購於QIAGEN公司。鎳親和層析柱洗脫緩衝液(pH均為7.6,溶劑均為水):
NTA-0:20毫摩爾/升 Tris-HCl,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-20:20毫摩爾/升 Tris-HCl,20毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-40:20毫摩爾/升 Tris-HCl,40毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-60:20毫摩爾/升 Tris-HCl,60毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-80:20毫摩爾/升 Tris-HCl,80毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-100:20毫摩爾/升 Tris-HCl,100毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-200:20毫摩爾/升 Tris-HCl,200毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
NTA-300:20毫摩爾/升 Tris-HCl,300毫摩爾/升咪唑,0.5摩爾/升 NaCl,10%(克/100毫升)甘油。
每種洗脫緩衝液的洗脫體積均為5毫升,收集NTA-300過柱後的液體(AiiA-AIO6蛋白液)。用對照菌代替重組菌進行步驟1至5,收集NTA-300過柱後的液體(對照液)。誘導、表達和純化過程中的蛋白電泳圖見圖1。圖1中,1為對照菌誘導後的CTP(步驟4的上清);2:重組菌誘導前的CTP;3:重組菌誘導後的CTP(步驟3的上清);4:重組菌誘導後的CTP(步驟4的上清);M:低分子量蛋白質Marker;5:AiiA-AIO6蛋白液;CTP即細胞總蛋白。重組菌純化後得到電泳純的單一條帶,分子量約為35kDa(與預測分子量相近)。對照菌沒有得到目標大小的蛋白。
六、酶活測定
N-醯基高絲氨酸內酯酶的活性檢測方法如下(瓊脂平板擴散法):
1、將3-oxo-C8-HSL(底物)溶於0.1摩爾/升 PBS緩衝液(pH8.0)中,使其終濃度為1毫克/升,即為3-oxo-C8-HSL溶液;ATmm培養基平板用手術刀切割成4×60毫米的膠條。
2、標準曲線製備
分別向0.1摩爾/升 PBS緩衝液(pH8.0)中添加10、5、1、0.5、0.1、0.05、0.01、0.005和0.001微升的3-oxo-C8-HSL溶液,用0.1摩爾/升 PBS緩衝液(pH8.0)將體系定容至200微升,搖勻;30℃溫育30分鐘後,反應體系中加入50微升 10%(質量百分含量)SDS水溶液終止反應;用牙籤將檢測菌(KYC55)間隔4毫米點接於膠條上,將10微升的反應終止的反應液滴至膠條左端,30℃培養24小時後計數變藍點數,計算距離(毫米),以加入3-oxo-C8-HSL物質量為縱軸(y),以擴散距離為橫軸(x),建立回歸方程。回歸方程:y=0.00000652×e;e=2.718281828459045。
3、待測溶液的酶活測定
反應體系:將20微升待測溶液,179微升的0.1摩爾/升 PBS緩衝液(pH8.0)和1微升3-oxo-C8-HSL溶液混合,搖勻;30℃溫育30分鐘後,反應體系中加入50微升 10%(質量百分含量)SDS水溶液終止反應;用牙籤將檢測菌(KYC55)間隔4毫米點接於膠條上,將10微升反應終止的反應液滴至膠條左端,30℃培養24小時後計數變藍點數,計算距離,按酶活計算公式計算待測溶液的酶活。
酶活(U/ml)單位定義:在30℃下每分鐘分解1納摩爾 3-oxo-C8-HSL的酶量被定義為一個酶活單位。以回歸方程(見圖2)為基礎建立如下酶活計算公式:酶每活(U)=6.52×(1.4163-1.4163)×50/30/10
Xs為待測溶液進行上述處理後的擴散距離;Xck為用0.1摩爾/升 PBS緩衝液(pH8.0)代替待測溶液進行上述處理後的擴散距離。
將AiiA-AIO6蛋白液用0.1摩爾/升 PBS緩衝液(pH8.0)配製為0.02毫克/毫升的溶液(作為待測溶液甲),進行N-醯基高絲氨酸內酯酶的活性檢測。將對照液用0.1摩爾/升PBS緩衝液(pH8.0)稀釋(稀釋倍數同AiiA-AIO6蛋白液),作為待測溶液乙進行N-醯基高絲氨酸內酯酶的活性檢測。
待測溶液甲的酶活為877.04U/ml。待測溶液乙的酶活為0U。AiiA-AIO6蛋白的比活力=待測溶液甲的酶活/待測溶液甲中的總蛋白濃度=583.33U/毫克。AiiA-AIO6蛋白動力學的測定結果為Vmax=121.95納摩爾/(毫克·分鐘),Km=0.015毫摩爾/升。
實施例3、AiiA-AIO6蛋白作為N-醯基高絲氨酸內酯酶的酶學性質
一、最適pH
將實施例2製備的AiiA-AIO6蛋白液用0.1摩爾/升 PBS緩衝液(pH8.0)配製為0.02毫克/毫升的溶液(作為待測溶液),進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測中,除了緩衝液其它同實施例2的步驟六的3)。
分別採用如下幾種緩衝液:
pH 4.0、5.0、6.0的0.1摩爾/升的McIlvaine緩衝液;
pH 5.0、6.0、7.0、7.5、8.0的0.1摩爾/升 PBS緩衝液;
pH 8.0、8.5、9.0的Tris-HCl緩衝液;
pH 9.0、10.0、11.0的0.1摩爾/升的甘氨酸-NaOH緩衝液(NaOH-Gly)。
將採用0.1摩爾/升 PBS緩衝液(pH8.0)時待測溶液的酶活記為100%(酶活值為877.04U/ml)。採用各種緩衝液的相對酶活力見圖3。採用McIlvaine緩衝液,pH4.0時的相對酶活為0%,pH5.0時的相對酶活為0%,pH6.0時的相對酶活為97.03%。採用PBS緩衝液,pH5.0時的相對酶活為0%,pH6.0時的相對酶活為97.14%,pH7.0時的相對酶活為99.58%,pH7.5時的相對酶活為99.72%,pH8.0時的相對酶活為100%。採用Tris-HCl緩衝液,pH8.0時的相對酶活為57.35%,pH8.5時的相對酶活為57.35%,pH9.0時的相對酶活為56.22%。採用甘氨酸-NaOH緩衝液,pH9.0時的相對酶活為35.82%,pH10.0時的相對酶活為12.48%,pH11.0時的相對酶活為2.41%。AiiA-AIO6蛋白的最適作用pH為8.0,採用PBS緩衝液在pH6.0-8.0保持90%以上的相對酶活性,pH低於5或高於10.0幾乎喪失所有酶活。
二、pH穩定性
將實施例2製備的AiiA-AIO6蛋白液用不同緩衝液配製為0.02毫克/毫升的溶液,30℃下處理1小時後作為待測溶液進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測的方法同實施例2的步驟六的3)。
分別用如下幾種緩衝液進行處理:pH 4.0、5.0的0.1摩爾/升的McIlvaine緩衝液;pH 6.0、7.0、8.0的0.1摩爾/升 PBS緩衝液;pH 9.0的Tris-HCl緩衝液;pH 10.0、11.0、12.0的0.1摩爾/升的甘氨酸-NaOH緩衝液(NaOH-Gly)。
將pH為8.0處理1小時後待測溶液的酶活記為100%,此時的酶活值為877.04U/ml。採用各種緩衝液處理後的待測酶液的相對酶活力見圖4。pH7.0時的相對酶活為100.10%、pH8.0時的相對酶活為100%、pH9.0時的相對酶活為100.00%、pH10時的相對酶活為99.92%、pH11時的相對酶活為99.92%、pH12時的相對酶活為100%。AiiA-AIO6蛋白在pH範圍為7.0-12.0間都很穩定,保持80%以上的酶活。
三、AiiA-AIO6蛋白作為N-醯基高絲氨酸內酯酶的最適溫度
將實施例2製備的AiiA-AIO6蛋白液用0.1摩爾/升 PBS緩衝液(pH8.0)配製為0.02毫克/毫升的溶液(作為待測溶液),進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測中,除了溫度其它同實施例2的步驟六的3)。
將溫度為30℃時待測溶液的酶活記為100%,此時的酶活值為877.04U/ml。採用各種溫度的相對酶活力見圖5。0℃時的相對酶活為99.53%、10℃時的相對酶活為99.53%、20℃時的相對酶活為99.53%、30℃時的相對酶活為100%、40℃時的相對酶活為94.83%、50℃時的相對酶活為77.34%、60℃時的相對酶活為45.81%,60℃時的相對酶活不足1%。AiiA-AIO6蛋白的最適作用溫度30℃。
四、AiiA-AIO6蛋白作為N-醯基高絲氨酸內酯酶的熱穩定性
將實施例2製備的AiiA-AIO6蛋白液用0.1摩爾/升 PBS緩衝液(pH8.0)配製為0.02毫克/毫升的溶液,在不同溫度下(80℃或90℃)分別保溫不同時間後作為待測溶液進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測的方法同實施例2的步驟六的3)。
將未經保溫處理的待測溶液的酶活記為100%,此時的酶活值為877.04U/ml。採用各種溫度和處理時間處理後的相對酶活力見圖6。80℃保溫1分鐘為99.86%,80℃保溫2分鐘為99.86%、80℃保溫3分鐘為99.86%,80℃保溫5分鐘為99.86%、80℃保溫10分鐘為99.48%、80℃保溫20分鐘為99.48%、80℃保溫30分鐘為80.92%、80℃保溫60分鐘為74.85%。90℃保溫1分鐘為99.86%、90℃保溫2分鐘為99.86%,90℃保溫3分鐘為99.68%、90℃保溫5分鐘為99.68%、90℃保溫10分鐘為99.48%、90℃保溫20分鐘為86.58%、90℃保溫30分鐘為76.99%、90℃保溫60分鐘為0%。AiiA-AIO6蛋白熱穩定性較好。
五、不同金屬離子及相關化學試劑對酶活的影響
將實施例2製備的AiiA-AIO6蛋白液作為待測溶液進行N-醯基高絲氨酸內酯酶的活性檢測(定容前在反應體系分別加入不同的化學試劑,使其在反應體系中的終濃度為1mM或10mM,其它同實施例2的步驟六的3)。
以不加入化學試劑的反應體系中待測溶液的酶活記為100%(CK),此時的酶活值為877.04U/ml。加入各種化學試劑後待測酶液的相對酶活結果見表2。
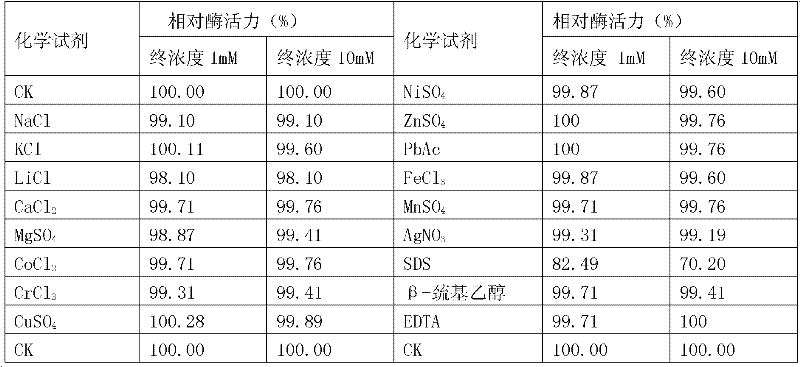
表2不同金屬離子及相關化學試劑對AiiA-AIO6的影響
六、AiiA-AIO6蛋白作為N-醯基高絲氨酸內酯酶的抗性
將實施例2製備的AiiA-AIO6蛋白分別溶於如下溶液(蛋白濃度為0.02毫克/毫升):
溶液A:將胰蛋白酶溶於0.1摩爾/升 Tris-HCl(pH 7.0),濃度為1毫克/毫升;
溶液B:將α-糜蛋白酶溶於0.1摩爾/升 Tris-HCl(pH 7.0),濃度為1毫克/毫升;
溶液C:將蛋白酶K溶於0.1摩爾/升 Tris-HCl(pH 7.5),濃度為1毫克/毫升;
溶液D:將枯草桿菌蛋白酶A溶於0.1摩爾/升 Tris-HCl(pH 7.5),濃度為1毫克/毫升;
溶液E:將膠原蛋白酶溶於0.1摩爾/升 Tris-HCl(pH 7.5),濃度為1毫克/毫升。
30℃保溫30分鐘或60分鐘後,作為待測溶液進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測的方法同實施例2的步驟六的3)。
將實施例2製備的AiiA-AIO6蛋白溶於0.1摩爾/升 PBS緩衝液(pH8.0),濃度為0.02毫克/毫升,30℃保溫30分鐘或60分鐘後,作為待測溶液的對照,此時的酶活值均為877.04U/ml,該酶活作為100%。
各種處理後的相對酶活力見圖7。除蛋白酶K外AiiA-AIO6蛋白對於胰蛋白酶、糜蛋白酶、枯草芽孢桿菌蛋白酶A、膠原蛋白酶都有很好的抗性。加入蛋白酶K保溫30分鐘的相對酶活為75.22%,保溫60分鐘的相對酶活為50.19%。
七、AiiA-AIO6蛋白作為N-醯基高絲氨酸內酯酶的底物特異性
將實施例2製備的AiiA-AIO6蛋白液用0.1摩爾/升 PBS緩衝液(pH8.0)配製為0.02毫克/毫升的溶液,作為待測溶液進行N-醯基高絲氨酸內酯酶的活性檢測(活性檢測中,除了底物其它實施例2的步驟六的3)。
分別採用如下底物:C4-HSL、C6-HSL、C7-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL、3-oxo-C6-HSL、3-oxo-C8-HSL、3-oxo-C 14-HSL、3-oxo-C 10-HSL、3-oxo-C 14-HSL、3-hydroxy-C12-HSL、3-hydroxy-C14-HSL。
將3-oxo-C8-HSL作為底物的酶活記為100%,此時的酶活值為877.04U/ml。C4-HSL,C6-HSL,C7-HSL作為底物的相對酶活為316.14U/ml,C8-HSL作為底物的相對酶活為126.10U/ml,C10-HSL作為底物的相對酶活為287.74U/ml,3-oxo-C6-HSL作為底物的相對酶活為0.92U/ml,3-oxo-C14-HSL作為底物的相對酶活為29.46U/ml,3-oxo-C12-HSL作為底物的相對酶活為172.94U/ml,3-oxo-C10-HSL作為底物的相對酶活為232.17U/ml,3-hydroxy-C12-HSL作為底物的相對酶活為28.20U/ml。結果顯示,除C12-HSL、C14-HSL、3-hydroxy-C14-HSL外,AiiA-AIO6蛋白對以上信號分子均具有降解作用。
榮譽表彰
2020年7月14日,《高比活耐熱N-醯基高絲氨酸內酯酶AiiA-AIO6及其編碼基因與套用》獲得第二十一屆中國專利獎優秀獎。

