基本介紹
- 中文名:電化學發電
- 外文名:Electrochemical power generation
- 主要套用於:化學電源、生命現象研究
- 主要產品:化學電池
- 最早始於:1663年
- 典型代表:原電池、燃料電池
發展
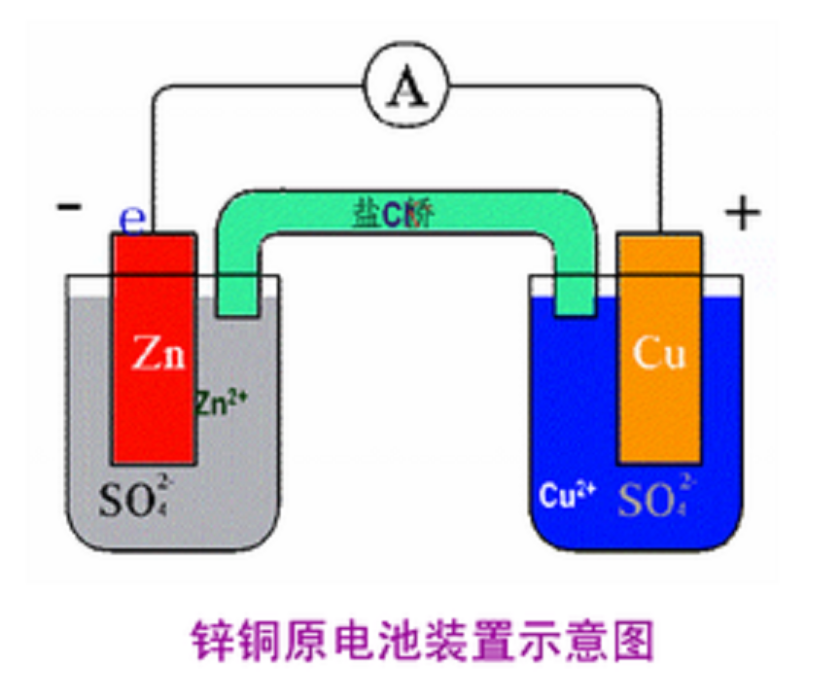
原電池
組成原電池的基本條件
原電池工作原理
原電池的電極的判斷
原電池的判定
原電池原理的腐蝕


電化學發電主要指利用電化學原理實現化學反應中的化學能轉化為電能。例如:燃料電池是將燃料的化學能通過化學反應轉化為電能的裝置。國際上一些科研機構和財團已經能生產出小到幾瓦,大到幾千千瓦的燃料電池。燃料電池的商業化套用一旦得...
電化學是研究兩類導體形成的帶電界面現象及其上所發生的變化的科學。電和化學反應相互作用可通過電池來完成,也可利用高壓靜電放電來實現(如氧通過無聲放電管轉變為臭氧),二者統稱電化學,後者為電化學的一個分支,稱放電化學。由於...
更新的氫能發電方式是氫燃料電池。這是利用氫和氧(成空氣)直接經過電化學反應而產生電能的裝置。換言之,也是水電解槽產生氫和氧的逆反應。70年代以來,日美等國加緊研究各種燃料電池,現已進入商業性開發,日本已建立萬千瓦級燃料電池...
生物電化學可以定義為一門套用電化學及實驗方法研究生物現象的邊緣分支學科。簡介 生物電化學是20世紀70年代由電生物學、生物物理學、生物化學以及電化學等多門學科交叉形成的一門獨立的學科。是用電化學的基本原理和實驗方法,在生物體和...
一種用於鋰離子電化學發電裝置的正電極的活性材料組合物,包含:‑式LiMO₂的鋰化氧化物,其中:0≤x≤0.15,M表示NiₐMnCoM',其中a>0;b>0;c>0;d≥0且a+b+c+d=1;M'選自B、Mg、Al、Si、Ca、Ti、V、Cr、...
燃料電池是一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器,它是繼水力發電、熱能發電和原子能發電之後的第四種發電技術。由於燃料電池是通過電化學反應把燃料的化學能中的吉布斯自由能部分轉換成電能,不受卡諾循環...
電力燃料電池是指一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器。簡介 電力燃料電池是指一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器。原理 燃料電池是一種能量轉化裝置,它是按電化學...
乾電池、蓄電池是一種儲能裝置,是把電能貯存起來,需要時再釋放出來;而氫燃料電池嚴格地說是一種發電裝置,像發電廠一樣,是把化學能直接轉化為電能的電化學發電裝置。另外,氫燃料電池的電極用特製多孔性材料製成,這是氫燃料電池的...
固體氧化物燃料電池(SOFC)是一種將化學能直接轉化成電能的全固態電化學發電裝置,具有環境友好、能量轉換效率高和燃料適應廣泛等優點,是21世紀各國競相發展的一種新型綠色能源。SOFC工作時陽極和陰極的損失較小,極化損失主要集中在電解質...
等離子燃料電池是利用電弧等離子的方式,使參加電化學反應的燃料和氧化劑發生電離,並利用磁場作用將正負離子分開,使之通過電子的定向移動,發生電化學反應,並將燃料的化學能以電能的形式輸出的電化學發電裝置。基本結構 燃料|電極|電解質|...
燃料電池是一種把燃料所具有的化學能直接轉換成電能的化學裝置,又稱電化學發電器。它是繼水力發電、熱能發電和原子能發電之後的第四種發電技術。由於燃料電池是通過電化學反應把燃料的化學能中的吉布斯自由能部分轉換成電能,不受卡諾循環...
氫燃料電池與普通電池的區別主要在於:乾電池、蓄電池是一種儲能裝置,它把電能儲存起來,需要的時候再釋放出來;而氫燃料電池嚴格的說是一種發電裝置,像發電廠一樣,是把化學能直接轉化為電能的電化學發電裝置。而使用氫燃料電池發電,...
水果電池是利用水果中的化學物質和金屬片發生反應產生電能的一種電池。原理 水果電池的發電原理是:兩種金屬片的電化學活性是不一樣的,其中更活潑的那邊的金屬片能置換出水果中的酸性物質的氫離子,由於產生了正電荷,整個系統需要保持...
氫燃料電池有軌電車是使用氫燃料電池技術,通過氫與氧的直接電化學反應發電。突破了燃料電池/超級電容混合動力牽引和控制等一系列關鍵技術,完全取消受電弓和接觸網,填補了該領域空白,實現污染物“零排放”和全程“無網”運行。世界首列...
由於氫離子導體(或稱質子導體)在能源及電化學器件的套用前景,引起人們的研究興趣與重視。一種經濟又無污染的儲能方法是:水電解得到氫,再將氫作為燃料,通過氫氧燃料電池來發電,在此過程中氫和氧又化合成水。這種理想的循環可以藉助水...
