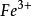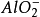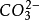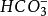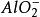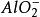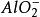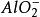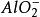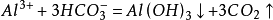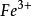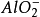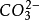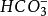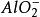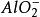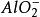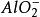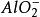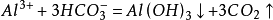基本介紹
如:泡沫
滅火器中的主要化學物質是碳酸氫鈉與硫酸鋁,互相促進水解生成二氧化碳氣體和
氫氧化鋁沉澱,從而產生大量的泡沫。
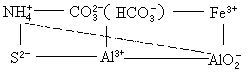 雙水解
雙水解Al(HCO3)3=Al(OH)3↓+3CO2↑
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
AlN+3H2O=Al(OH)3↓+NH3↑
弱酸
陰離子與弱鹼陽離子在
水溶液中互相促進水解,水解程度增大。水解問題包含徹底水解和不徹底水解。有些互促
水解反應不能完全進行,有些互促水解反應能完全進行(俗稱“雙水解反應”)。常見的雙水解進行完全的有:
、
與
、
(
)。
發生條件
首先我們來分析Al
3+與HCO
3–在水溶液中為什麼能發生“雙水解反應”而Mg2
+與CO
32-或HCO
3-卻不能發生“雙水解反應”?互相促進水解其水解程度增大,由於
Al(OH)3溶解度非常小且
H2CO3又不穩定易分解即生成的水解產物能脫離反應體系,根據
平衡移動原理水解反應繼續向右進行,直至反應完全進行;但
Mg(OH)2溶解度比 Al(OH)3大些,不容易脫離反應體系,則水解反應進行到一定程度就達到平衡,水解反應不能完全進行。由上不難看出: 生成的水解產物脫離反應體系是反應得以完全進行的重要原因. 因此, “雙水解反應”發生的條件之一是:水解產物是容易脫離反應體系(溶解度非常小)的物質如:Al(OH)
3、
Fe(OH)3或
H2S、CO
2等極難溶的氣體。當然,若互相促進
水解程度非常大
水解反應也可以認為完全進行。
綜上所述,雙水解反應能否完全進行決定於兩個因素:1.互相促進水解程度大小(包括物質本性、外界條件等的影響)2.水解產物的溶解度。
推論及套用
發生雙水解的離子不共存。
下面我們思考這樣一個問題:Al3+遇到比碳酸還弱的酸的酸根如:ClO-、SiO32-、AlO2-等會不會發生“雙水解反應”呢?根據以上條件,答案是肯定的。
完全水解的意思:
當弱酸的酸根與弱鹼的陽離子同時存在於水溶液中時,弱酸的酸根水解生成的氫氧根離子與弱鹼的陽離子水解生成的氫離子反應生成水而使兩種離子的水解平衡向水解方向移動而互相促進水解,而水解完全。
重要方程
雙水解離子方程式用“═”連線,且標記“↑”和“↓”
中學化學中常見的能發生“水解相互促進的反應”的離子對有:(水溶液中,AlO2-以Al(OH)3-的形式存在)
Al3+與HCO3-、CO32-、HS-、S2-、ClO-、
、SiO32-;
Fe3+與HCO3–、CO32–、ClO-、
、SiO32-等;
實際上,由於Al(OH)3、Fe(OH)3溶解度非常小,比碳酸稍弱的酸的酸根與Fe3+、Al3+也能發生“雙水解反應”。
1、【鋁離子和碳酸氫根離子】
2、【鋁離子和碳酸根離子】
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
3、【鋁離子和硫離子】
2Al3++3S2-+6H20=2Al(OH)3↓+3H2S↑
4、【鋁離子和HS-(硫氫根)離子】
Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
Fe3++3(Al(OH)4)-=Fe(OH)3↓+3Al(OH)3↓
6、【鐵離子和碳酸根離子】
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
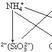
7、【銨根離子和四羥基合鋁酸根離子】
NH4++(Al(OH)4)-=NH3·H2O+Al(OH)3↓
8、【鐵離子和碳酸氫根離子】
Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(因為反應物和生成物中都有水抵消,故不表示出來)
9、【銨根離子和偏鋁酸根離子】
AlO2- + NH4+ + H2O == Al(OH)3↓+ NH3↑
10、【鋁離子和偏鋁酸根離子】
Al3+ + 3AlO2- + 6H2O ═ 4Al(OH)3↓
常見謠言
謠言1:鋁離子與碳酸氫根發生完全雙水解,即Al3++3HCO3-=Al(OH)3↓+3CO2↑
駁斥:鋁離子與碳酸氫根並不一定發生完全雙水解,只要稍加控制反應條件,鋁離子與碳酸氫根就可以發生反應形成鹼式碳酸鋁鹽如碳酸鋁銨,如以下實例:
對碳酸鋁銨合成的工藝條件進行了研究,研究了反應物的滴定次序、溶液濃度及加入速度、反應溫度等因素對反應產物的影響。實驗結果表明,Al3+周圍有足夠的碳酸氫銨是生成碳酸鋁銨的關鍵,必須將硫酸鋁銨加入到碳酸氫銨溶液中,並且碳酸氫銨的濃度大於1.0mol/L才有可能生成碳酸鋁銨。
又如以下實例,碳酸根與鋁離子並未發生完全雙水解,而是形成碳酸鋁銨:
以硝酸鋁為原料,碳酸銨為沉澱劑,合成前驅體碳酸鋁銨,然後煅燒得到納米級氧化鋁粉體。
不僅如此,而且事實上國外最遲在二十世紀七十年代就已經將上述不完全雙水解的產物碳酸鋁鈉作為化工產品打入市場。
謠言2:醋酸鐵雙水解不存在,因為Fe3+的水解程度很高,醋酸的酸性不足以產生Fe3+的鹽類
變體:醋酸鐵在水中……,醋酸根水解消耗氫離子,鐵離子水解消耗氫氧根,這樣會導致雙水解,即水中生成的是醋酸分子還有氫氧化鐵沉澱。
駁斥:鐵離子與醋酸根的雙水解反應並不完全,以至於形成的鹼式醋酸鐵(而不是形成氫氧化鐵)可以在水中比較穩定的存在,並且可以通過乙酸溶解氫氧化鐵來進行製備。
鹼式醋酸鐵的性質:
紅褐色葉片狀結晶或無定形粉末,略帶醋酸氣味。冷水中緩慢溶解,熱水中迅速溶解,溶於乙醇、醋酸。應避光保存。
附製法:
FeCl3+3NH3·H2O→Fe(OH)3+3NH4Cl
2Fe(OH)3→Fe2O3+3H2O
Fe2O3+4CH3COOH→2Fe(OH)(CH3COO)2+H2O
室溫下,在稀三氯化鐵溶液中加入氨水,生成氫氧化鐵(Ⅲ)沉澱。採用傾瀉法用冷水對沉澱進行多次洗滌,抽濾出沉澱,再用水充分洗滌,數日後,得到膏狀水合氧化鐵(Ⅲ),將其加熱溶於大致等量的乙酸中。將所得溶液放在蒸發皿中,放在通風良好處數日,析出鹼式醋酸鐵結晶。
謠言3:Ag+ 與 CO32- ,會發生雙水解反應,生成CO2氣體,和AgOH沉澱
駁斥:硝酸銀與碳酸鈉並不發生雙水解反應,而是發生正常的複分解反應形成碳酸銀沉澱,不應被網路上的一些錯誤見解誤導。下為碳酸銀的製法:
將碳酸鈉或碳酸氫鈉加入到硝酸銀溶液中。用碳酸鈉為原料時,為了避免生成的碳酸銀沉澱中含氧化物,所以應避免加入過量的沉澱劑。將沉澱過濾,用水洗滌後,在濃硫酸和五氧化二磷上乾燥至恆重。因為純的碳酸銀對光十分敏感,所以應在紅光下處理產品。
在攪拌下,將碳酸鈉稀溶液緩慢加到硝酸銀水溶液中 ( 使硝酸銀稍過量) ,並繼續攪拌至反應完全。然後過濾,濾出的碳酸銀用少量水洗滌至合格,風乾後即得成品。