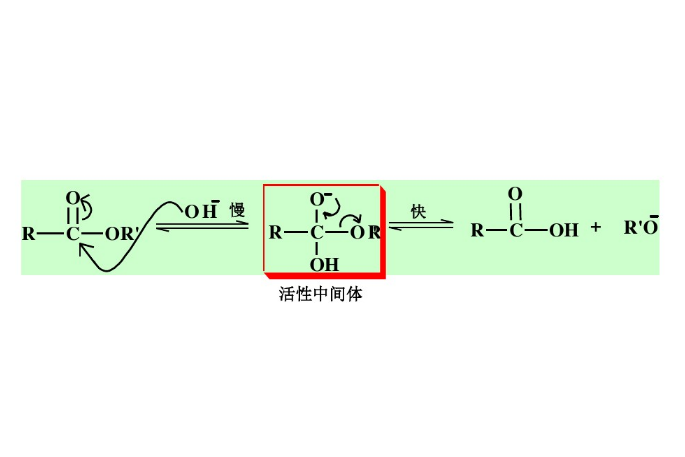
酯在鹼性溶液中的水解,產生鹼性較強的烷氧基負離子和酸性較弱的羧酸,二者發生反應使平衡移向產物,故酯的鹼性水解是不可逆的。多數酯在鹼催化下按雙分子鹼催化醯氧斷裂(Bac2)機理水解。
基本介紹
- 中文名:雙分子鹼催化醯氧斷裂
- 外文名:Bac2
背景知識,相關原理,影響因素,相關知識,
背景知識
羧酸衍生物的物化性質
酯常為液體,低級酯具有香味,酯的比重小,在水中溶解度低,是優良的有機溶劑。羧酸衍生物的化學性質可以分為兩大類:一是衍生物的相互轉化;另外是衍生物自身的特性反應。
羧酸衍生物的水解
根據酸鹼的催化,烷氧基和醯氧基的斷裂,可以分為8種類型,其中Bac1和Aal2尚未被發現。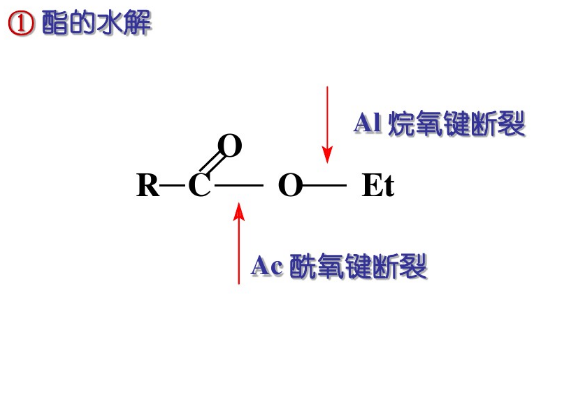


相關原理
酯在鹼性溶液中的水解,產生鹼性較強的烷氧基負離子和酸性較弱的羧酸,二者發生反應使平衡移向產物,故酯的鹼性水解是不可逆的。羥基進攻酯的羰基碳,形成帶負電荷的四面體結構的中間體,是反應速率最慢的一步。緊接著烷氧基離去,形成羧酸和烷鋮基負離子,兩者迅速發生酸鹼中和反應(不可逆反應),生成醯氧基負離子(鹽〉和醇。
多數酯在鹼催化下按 機理水解:
機理水解:

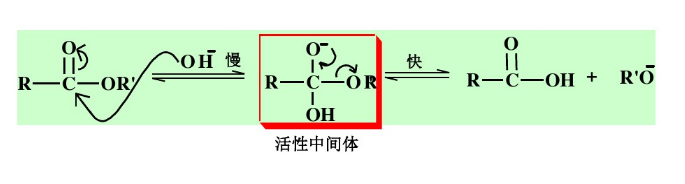
酯在鹼溶液中的水解反應的速率主要取決於四面體的中間體的穩定性,凡能分散負電荷的取代基,即在酯羰基附近連有的吸電子基越多,可使中間體穩定,反應越易進行。
影響因素
1 鹼水解的速率和氫氧根離子成正比。
2 羰基活性越大,α-C空阻越小,酯基空阻越小,反應速率越快。
3 形成的四面體中間體能量越低,反應速度越快。能分散負電荷的取代基對反應有利。
4 酯的鹼性水解是不可逆的,鹼的用量要超過催化劑量。
相關知識
酸催化酯水解的原理:
反應的第一步是酯中羰基質子化,從而增加羰基碳的正電性,有利於親核試劑的進攻。第二步是質子化的羰基與水加成形成帶正電荷的四面體結構的中間體。第三步是質子轉移和消除醇分子,生成羧酸。該反應速率取決於形成四面體結構中間體的穩定性。與鹼溶液水解反應一樣,R和基閉體積增大,反應速率降低;與鹼液水解不同的是中間體帶正電荷,所以R基團供電子能力增強,使中間體穩定而水解反應速率加快。