《軍團菌種快速檢測試劑盒及其檢測方法》是廣州金域醫學檢驗中心有限公司於2009年7月9日申請的發明專利,該專利的申請號為2009100409563,公布號為CN101597647,公布日為2009年12月9日,發明人是朱慶義、詹曉勇、李連青、胡朝暉、張遠志,該專利涉及團菌種檢測技術領域。
《軍團菌種快速檢測試劑盒及其檢測方法》包括細菌基因組DNA提取液,PCR反應液、PCR產物純化液,酶切反應液等組成,以上液體分別置於容器中;所述的PCR反應液包括第一PCR反應液和第二PCR反應液,第一PCR反應液和第二PCR反應液分別置於容器中。該發明另外公開了該試劑盒的檢測方法。該發明不僅可運用於臨床標本如痰液、支氣管灌洗液中軍團菌種的檢測,也可以運用於水標本中軍團菌檢測,具有快速,簡便,易於使用的優點。
2014年11月6日,《軍團菌種快速檢測試劑盒及其檢測方法》獲得第十六屆中國專利優秀獎。
(概述圖為《軍團菌種快速檢測試劑盒及其檢測方法》摘要附圖)
基本介紹
- 中文名:軍團菌種快速檢測試劑盒及其檢測方法
- 公布號:CN101597647
- 公布日:2009年12月9日
- 申請號:2009100409563
- 申請日:2009年7月9日
- 申請人:廣州金域醫學檢驗中心有限公司
- 地址:廣東省廣州市海珠區新港東路2429號三樓
- 發明人:朱慶義、詹曉勇、李連青、胡朝暉、張遠志
- 分類號:C12Q1/68(2006.01)I、C12R1/01(2006.01)N
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,附圖說明,權利要求,實施方式,榮譽表彰,
專利背景
2009年7月前,軍團菌檢測試劑盒主要分為兩大類。一是利用抗原抗體反應檢測軍團菌特異抗體或抗原,此類試劑盒包括軍團菌ELISA法試劑盒以及軍團菌膠體金試劑盒,因為軍團菌相關抗原或抗體在軍團菌感染病人體內出現較晚,一般需要一周及以上的時間才能檢測到,同時只能檢測嗜肺軍團菌,而且具有一定的交叉反應,所以該類型的試劑盒具有一定的局限性。第二類是利用分子生物學方法檢測軍團菌,如螢光定量PCR檢測嗜肺軍團菌試劑盒,該試劑盒僅可用以檢測嗜肺軍團菌,對非嗜肺軍團菌不能檢測。雖然臨床上80%以上的軍團菌感染都是由嗜肺軍團菌引起,水環境也廣泛存在嗜肺軍團菌,但是非嗜肺軍團菌也具有較為廣泛的存在性和一定的感染力。因此一種既能檢測軍團菌屬又能鑑別出屬於嗜肺軍團菌與非嗜肺軍團菌種的檢測試劑盒是很有必要。
發明內容
專利目的
《軍團菌種快速檢測試劑盒及其檢測方法》的目的是針對以上所述軍團菌檢測試劑盒存在的不足,提供一種不僅能檢測臨床和環境水標本中的軍團菌,而且可以對軍團菌進行分型為嗜肺軍團菌與非嗜肺軍團菌的軍團菌種快速檢測試劑盒。該發明的另一個目的是提供一種軍團菌種快速檢測試劑盒的檢測方法。
技術方案
軍團菌種快速檢測試劑盒,包括細菌基因組DNA提取液,PCR反應液、PCR產物純化液,酶切反應液等組成,以上液體分別置於容器中;
所述的PCR反應液包括第一PCR反應液和第二PCR反應液,第一PCR反應液和第PCR反應液分別置於容器中。
其中第一PCR反應液含有的組分及組分濃度如下:
Taq DNA聚合酶 | 0.04~0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200~300微摩爾/升 |
Tris~HCl(pH8.3) | 8~12毫摩爾/升 |
KCl | 40~60毫摩爾/升 |
MgCl2 | 1.5~2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15~0.25微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.15~0.25微摩爾/升 |
所述的第二PCR反應液含有的組分及組分濃度如下:
Taq DNA聚合酶 | 0.04~0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200~300微摩爾/升 |
Tris~HCl(pH8.3) | 8~12毫摩爾/升 |
KCl | 40~60毫摩爾/升 |
MgCl2 | 1.5~2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15~0.25微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.15~0.25微摩爾/升 |
所述的DNA提取液含有的組分及組分濃度如下:
Chelex 100 resin | 5% |
Tris~HCL[pH8.3] | 10毫摩爾/升 |
EDTA~Na2 | 0.1毫摩爾/升 |
NaN3 | 0.1% |
蛋白酶K | 100微克/毫升 |
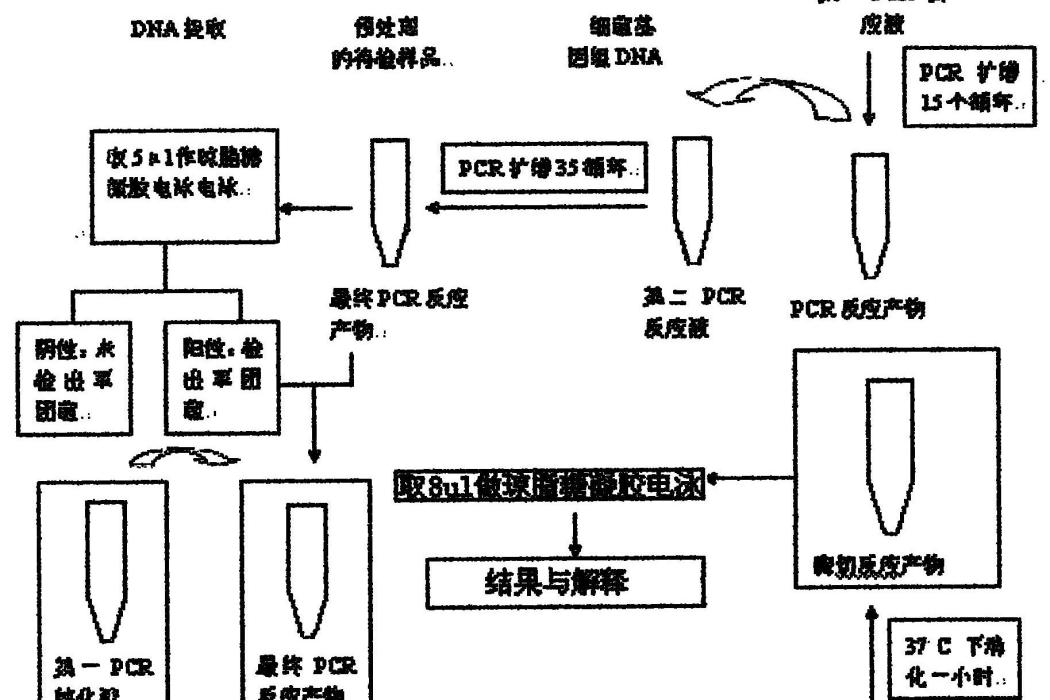
快速檢測軍團菌種試劑盒的檢測方法,其檢測步驟如下:套用DNA提取液提取檢測樣品中的細菌基因組DNA;以細菌基因組DNA為模板,套用第一PCR反應液擴增15~20個循環後,以前一步PCR反應產物為模板,用第二PCR反應液擴增35~40循環,將所得的最終PCR產物作瓊脂糖凝膠電泳;將第一PCR純化液與最終PCR產物混合後,加入到PCR純化柱內,離心後加入第二PCR純化液,再次離心後,加入第三PCR純化液後離心,得到PCR純化產物;將PCR純化產物加入到酶切反應液中消化0.5~2.0小時後,將酶切產物做瓊脂糖凝膠電泳檢測。
改善效果
該發明不僅可運用於臨床標本如痰液、支氣管灌洗液中軍團菌種的檢測,也可以運用於水標本中軍團菌檢測,具有快速,簡便,易於使用的優點。同時該試劑盒還可以鑑別軍團菌種,即通過該試劑盒的檢測,可以獲知臨床標本與水環境標本中軍團菌的類型,即是嗜肺軍團菌、或非嗜肺軍團菌、或二者兼有。總的來說,PCR反應液檢測軍團菌屬具有良好的敏感性和特異性,敏感性達到10~10cfu/毫升,特異性在95%以上;酶切反應液可對檢測出的軍團菌屬分型到種,分型準確率達99%。
附圖說明
圖1為該發明軍團菌種快速檢測試劑盒的實施流程示意圖;
圖2a為PCR陽性結果條帶圖:PCR反應後瓊脂糖凝膠電泳檢測中出現226bp條帶說明,樣品中檢測出軍團菌;
圖2b為PCR陰性結果條帶圖:PCR反應後瓊脂糖凝膠電泳檢測未出現226bp條帶,說明樣品中未檢測出軍團菌,報告為:未檢測出軍團菌;
圖2c為酶切陰性結果條帶圖:酶切後,瓊脂糖凝膠電泳檢測條帶與對照條帶比較,若只有226bp條帶,則說明樣品中僅有非嗜肺軍團菌[非菲氏(L.feeleii)及昆氏軍團菌(L.quinlivanii);
圖2d為酶切陽性結果1條帶圖:酶切後出現180bp條帶,說明檢測出嗜肺軍團菌;
圖2e為酶切陽性結果2條帶圖:酶切後出現153bp條帶,說明檢測出菲氏(L.feeleii)及昆氏(L.quinlivanii)軍團菌;
圖2f為其他結果1條帶圖:酶切後出現180bp,153bp條帶,說明樣品中含有嗜肺軍團菌和菲氏(L.feeleii)和(或)昆氏(L.quinlivanii)軍團菌。
圖2g為其他結果2條帶圖:酶切後出現153bp及180bp,和226bp條帶,說明樣品中檢出嗜肺軍團菌。菲氏或昆氏軍團菌及其他非嗜肺軍團菌;
圖2h為其他結果3條帶圖:酶切結果出現226bp與180bp,則樣品中檢測出非嗜肺軍團菌與嗜肺軍團菌,且其中非嗜肺軍團菌不為菲氏或昆氏軍團菌;
圖2i為其他結果4條帶圖:酶切結果出現226bp與153bp條帶,則樣品中檢測出非嗜肺軍團菌,其中非嗜肺軍團菌包含菲氏與昆氏軍團菌及其他非嗜肺軍團菌。
權利要求
1、軍團菌種快速檢測試劑盒,包括細菌基因組DNA提取液,PCR反應液、PCR產物純化液,酶切反應液等組成,以上液體分別置於容器中;所述的PCR反應液包括第一PCR反應液和第二PCR反應液,第一PCR反應液和第二PCR反應液分別置於容器中;其中第一PCR反應液含有的組分及組分濃度如下:
Taq DNA聚合酶 | 0.04~0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200~300微摩爾/升 |
Tris~HCl(pH8.3) | 8~12毫摩爾/升 |
KCl | 40~60毫摩爾/升 |
MgCl2 | 1.5~2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15~0.25微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.15~0.25微摩爾/升 |
所述的第二PCR反應液含有的組分及組分濃度如下:
Taq DNA聚合酶 | 0.04~0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200~300微摩爾/升 |
Tris~HCl(pH8.3) | 8~12毫摩爾/升 |
KCl | 40~60毫摩爾/升 |
MgCl2 | 1.5~2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15~0.25微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.15~0.25微摩爾/升 |
2、如權利要求1所述的軍團菌種快速檢測試劑盒的檢測方法,其特徵在於:所述的DNA提取液含有的組分及組分濃度如下:
Chelex 100 resin | 5% |
Tris~HCL[pH8.3] | 10毫摩爾/升 |
EDTA~Na2 | 0.1毫摩爾/升 |
NaN3 | 0.1% |
蛋白酶K | 100微克/毫升 |
實施方式
以下結合附圖和具體實施例對《軍團菌種快速檢測試劑盒及其檢測方法》作進一步說明:軍團菌種快速檢測試劑盒,包括細菌基因組DNA提取液,第一PCR反應液、第二PCR反應液、PCR產物純化液,酶切反應液等組成,以上液體分別置於容器中。其中,DNA提取液用於提取細菌基因組DNA;第一PCR反應液和第二PCR反應液是用來通過兩步PCR反應擴增軍團菌屬特異的基因片段。PCR產物純化液與純化柱一起純化PCR產物。酶切反應液用於消化PCR產物,然後將產物通過瓊脂糖凝膠電泳。
第一PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.04〜0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200〜300微摩爾/升 |
Tris~HCl(pH8.3) | 8〜12毫摩爾/升 |
KCl | 40〜60毫摩爾/升 |
MgCl2 | 1.5〜2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15〜0.25微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.15〜0.25微摩爾/升 |
ddH2O(雙蒸水) | 餘量 |
第二PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.04〜0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200〜300微摩爾/升 |
Tris~HCl(pH8.3) | 8〜12毫摩爾/升 |
KCl | 40〜60毫摩爾/升 |
MgCl2 | 1.5〜2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15〜0.25微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.15〜0.25微摩爾/升 |
ddH20(雙蒸水) | 餘量 |
最佳化的第一PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.05U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 25微摩爾/升 |
Tris~HCl(pH8.3) | 10毫摩爾/升 |
KCl | 50毫摩爾/升 |
MgCl2 | 1.8毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.20微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.20微摩爾/升 |
ddH2O(雙蒸水) | 餘量 |
PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.05U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 25微摩爾/升 |
Tris~HCl(pH8.3) | 10毫摩爾/升 |
KCl | 50毫摩爾/升 |
MgCl2 | 1.8毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.20微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.20微摩爾/升 |
ddH20(雙蒸水) | 餘量 |
所述的第一PCR反應液含有的組分及組分可以如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.04U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200微摩爾/升 |
Tris~HCl(pH8.3) | 8毫摩爾/升 |
KCl | 40毫摩爾/升 |
MgCl2 | 1.5毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.15微摩爾/升 |
ddH2O(雙蒸水) | 餘量 |
含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.046U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 200微摩爾/升 |
Tris~HCl(pH8.3) | 8毫摩爾/升 |
KCl | 40毫摩爾/升 |
MgCl2 | 1.5毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.15微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.15微摩爾/升 |
ddH2O(雙蒸水) | 餘量 |
所述的第一PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 300微摩爾/升 |
Tris~HCl(pH8.3) | 12毫摩爾/升 |
KCl | 60毫摩爾/升 |
MgCl2 | 2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.25微摩爾/升 |
引物2(CCAACAGCTAGTTGACATCG) | 0.25微摩爾/升 |
ddH20(雙蒸水) | 餘量 |
第二PCR反應液含有的組分及組分濃度如下表:
組成成分 | 濃度 |
Taq DNA聚合酶 | 0.06U/微升 |
4x dNTP(dATP,dCTP,dGTP,and dTTP)每種 | 300微摩爾/升 |
Tris~HCl(pH8.3) | 12毫摩爾/升 |
KCl | 60毫摩爾/升 |
MgCl2 | 2.0毫摩爾/升 |
引物1(AGGGTTGATAGGTTAAGAGC) | 0.25微摩爾/升 |
引物3(ATTCCACTACCCTCTCCCATACTCGAGTCAACC) | 0.25微摩爾/升 |
ddH2O(雙蒸水) | 餘量 |
所述的PCR產物純化液包括如下表三種DNA純化液,三種PCR產物純化液分別置於容器中,如下表:
PCR產物 | 純化液的組成 |
第一PCR純化液 | 碧雲天生物技術研究所的PCR純化試劑盒DNA結合液 |
第二PCR純化液 | 碧雲天生物技術研究所PCR純化試劑盒洗滌液 |
第三PCR純化液 | 碧雲天生物技術研究所PCR純化試劑盒洗脫液 |
所述的DNA提取液含有的組分及組分濃度如下表:
DNA提取液組成成分 | 濃度 |
Chelex 100 resin | 5% |
Tris~HCl[pH8.3] | 10毫摩爾/升 |
EDTA〜Na2(乙二胺四乙酸二鈉) | 0.1毫摩爾/升 |
NaN3(疊氮鈉) | 0.1% |
蛋白酶K | 100微克/毫升 |
快速檢測軍團菌種試劑盒的檢測方法,其檢測步驟如下:套用DNA提取液提取檢測樣品中的細菌基因組DNA;以細菌基因組DNA為模板,套用第一PCR反應液擴增15~20個循環後,以前一步PCR反應產物為模板,用第二PCR反應液擴增35~40循環,將所得的最終PCR產物作瓊脂糖凝膠電泳;將第一PCR純化液與最終PCR產物混合後,加入到PCR純化柱內,離心後加入第二PCR純化液,再次離心後,加入第三PCR純化液後離心,得到PCR純化產物;將PCR純化產物加入到酶切反應液中消化0.5~2.0小時後,將酶切產物做瓊脂糖凝膠電泳檢測。
快速檢測軍團菌種試劑盒的檢測方法的優選步驟是:快速檢測軍團菌種試劑盒的檢測方法的優選步驟是:如圖1所示,套用DNA提取液提取經過預處理的待檢樣品中的細菌基因組DNA;以細菌基因組DNA為模板,套用第一PCR反應液擴增15個循環後,以前一步PCR反應產物為模板,用第二PCR反應液擴增35循環,將所得的最終PCR產物,取取5微升最終PCR產物作瓊脂糖凝膠電泳電泳,根據圖2a和2b檢測出軍團菌;將第一PCR純化液與最終PCR產物混合後,加入到PCR純化柱內後依次經離心、洗滌、洗脫,離心後加入第二PCR純化液,再次離心後,加入第三PCR純化液後離心,得到PCR純化產物;將PCR純化產物加入到酶切反應液在37℃下消化1小時後,在酶切產物中取取8微升作瓊脂糖凝膠電泳,根據圖2a~2i所示對軍團菌進行分子分型。
<110>廣州金域醫學檢驗中心有限公司 | |
<120>軍團菌種快速檢測試劑盒及其檢測方法 | |
<130>no | |
<160>3 | |
<170>Patent In version 3.2 | |
<210>1 | |
<211>20 | |
<212>DNA | |
<213>引物1 | |
<400>1 | |
Agggttgata ggttaagagc | 20 |
<210>2 | |
<211>20 | |
<212>DNA | |
<213>引物2 | |
<400>2 | |
Ccaacagcta gttgacatcg | 20 |
<210>3 | |
<211>33 | |
<212>DNA | |
<213>引物3 | |
<400>3 | |
Attccactac cctctcccat actcgagtca acc | 33 |
榮譽表彰
2014年11月6日,《軍團菌種快速檢測試劑盒及其檢測方法》獲得第十六屆中國專利優秀獎。