《豬肺炎支原體克隆致弱株》是江蘇省農業科學院畜牧獸醫研究所於1999年6月25日申請的專利,該專利的公布號為CN1244580,授權公布日為2000年2月6日,發明人是邵國青、金洪效、毛洪先、錢建飛、侯繼波、何家惠。
《豬肺炎支原體克隆致弱株》提供一株豬肺炎支原體(Mhp)無細胞培養弱毒株,該株毒力較弱、安全,有較強的免疫原性,可在無細胞培養基上培養。該株是由氣喘病豬病肺接種於二花臉豬進行人工發病,並進行豬肺炎支原體病原再分離,鑑定後在江蘇二號無細胞培養基中致弱培養至322代次以上,形成有免疫原性的弱毒菌株。該菌株保藏在中國微生物菌種保藏管理委員會普通微生物中心,保藏編號是:CGMCCNo.0396。
2015年11月27日,《豬肺炎支原體克隆致弱株》獲得第十七屆中國專利獎優秀獎。
基本介紹
- 中文名:豬肺炎支原體克隆致弱株
- 申請人:江蘇省農業科學院畜牧獸醫研究所
- 申請日:1999年6月25日
- 申請號:991142764
- 公布號:CN1244580
- 公布日:2000年2月6日
- 發明人:邵國青、金洪效、毛洪先、錢建飛、侯繼波、何家惠
- 地址:江蘇省南京市孝陵衛鐘靈街50號
- Int.Cl.:C12N1/20
- 代理機構:江蘇省專利事務所
- 代理人:徐冬濤、周新亞
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
豬肺炎支原體(MycoplasmahyopneumoniaeMhp)是引起豬支原體肺炎(MycoplasmaPneumoniaeofswineMPS亦稱豬地方流行性肺炎、豬氣喘病)的主要病原,對養豬業造成重大的經濟損失。在豬呼吸道和其它部位還分離到豬鼻支原體(MycoplasmahyorhinisMpo)、豬絮狀支原體(MycoplasmaflocculareMf)、豬腹支原體(Mycoplasmasualvi)、脲原體(Ureaplasmas,尿原體)及多種無膽甾原體(Acholeplasmas),但這些支原體並不普遍,致病意義也較小。Mhp由Mare&Switzer及Goodwin&Whitlestone於1965年分離成功,菌體呈球型到短絲狀體,菌落很小,具有不明顯的中央隆起,在豬血清瓊脂平板上不產生膜,也不溶解馬、牛、豬、小雞紅血細胞,營養要求複雜,培養嚴格好氧。八十年代前,中國國內外完成Mhp的分離、鑑定、人工發病、診斷技術和藥物治療等系統研究。
但1999年前國際尚無豬肺炎支原體可無細胞培養的弱毒株,常規的豬肺炎支原體株(Mhp)或者毒力大,或者毒力弱而無免疫原性。
發明內容
專利目的
《豬肺炎支原體克隆致弱株》的目的是提供一株豬肺炎支原體(Mhp)無細胞培養弱毒株,該株毒力較弱、安全,有較強的免疫原性,可在無細胞培養基上培養。該株是由氣喘病豬病肺接種於二花臉豬進行人工發病,並進行豬肺炎支原體病原再分離,鑑定後在江蘇二號無細胞培養基中致弱培養至322代次以上,形成有免疫原性的弱毒菌株。該株培養72-144小時,以特定PCR引物可擴增出的特異片段,對該株的探針有特異性雜交反應,擴增產物有特定基因序列。
技術方案
《豬肺炎支原體克隆致弱株》的目的可以通過以下措施來達到:支原體(Mycoplasma,M.亦稱霉形體),最早由Nocard和Roux(1898)由牛傳染性胸膜肺炎病例中分離到,第一種支原體即絲狀支原體牛型亞種(M.mycoidessubsp.bovi/M.mycoidessubsp.mycoides)分離後由於其性質難以界定,遂將這一大類微生物命名為類胸膜肺炎微生物(PPLOS)。二十世紀五十年代中期,始用支原體這一名稱。1967年,Edward和Fnundt建議將其由裂殖菌綱分出來,單獨成立一個新綱:軟膜體綱(Mollicutes柔膜菌綱,軟皮體綱),支原體因缺少光合色素(葉綠素),有別於裂殖藻綱;缺少堅硬的細胞壁和細胞壁成份,有別於裂殖菌綱;可以進行無細胞培養而有別於濾過性病毒。它是最小的能夠自我複製的原核生物,基因組大小只有典型細菌的20-40%。國際細菌系統分類委員會軟膜體綱分類分會(ICSB-ISTM)將軟膜體綱分四個目:目I:支原體目(OrderI,Mycoplasmatales);目II:昆蟲原體目(OrderII,Entomoplasmatales);目III:無膽甾原體目(OrderIII,Acholoplasmatales);目IV:厭氧原體目(OrderIV,Anaeroplasmatales)。支原體目下設一個科即支原體科(FamilyI,Mycoplasmataceae),科內置兩屬:支原體屬(Mycoplasma),屬內有120種;尿原體屬(Ureaplasma),屬內有6種,常見的動物支原體屬此兩屬。
Mhp克隆致弱株(以下簡稱JS-99株)的分類地位為:原核生物界(Procaryotae)、軟壁菌門(Teneribacteria)、軟膜體綱(Mollicutes)、支原體目(OrderI,Mycoplasmatales)、支原體科(FamilyI,Mycoplasmataceae)、支原體屬(Mycoplasma)、豬肺炎支原體(Mycoplasmahyopneumoniae)。
豬肺炎支原體迄今全世界只有一個種,其模式株為:J(ATCC25934,NCTC10110),YppII(ATCC25617,NCTC10127)。
MhpJS-99株經系列生化試驗證明為支原體屬成員,生長抑制試驗檢測血清型證明與豬肺炎支原體J株為同一種。
1999年前該菌株保藏在中國微生物菌種保藏管理委員會普通微生物中心,保藏編號是:CGMCCNO.0396。
改善效果
《豬肺炎支原體克隆致弱株》與1999年6月之前的技術相比具有以下優點:
1、有免疫原性、毒力較弱且對豬安全;
2、能適應於KM2、Friis等無細胞培養基生長;
3、該弱毒株對二花臉和其它中國地方品種豬的免疫原性尚未測試,但安全性好,對二元雜交豬免疫保護率達80%以上。
技術領域
《豬肺炎支原體克隆致弱株》屬微生物新菌株。
權利要求
1.《豬肺炎支原體克隆致弱株》該菌株保藏在中國微生物菌種保藏管理委員會普通微生物中心,保藏編號是:CGMCCNO.0396。
實施方式
下面對該菌株的培養及鑑定作進一步描述:
一、無細胞培養KM2培養基組成及製法
Eagle’s溶液1000毫升、1.7%乳蛋白水解物溶於Dubeco-Vot’s磷酸緩衝液(即含10克水解乳蛋白)600毫升、自製鮮酵母抽出汁20毫升、健康豬血清400毫升、青黴素鉀鹽40萬單位、1%醋酸鉈溶液25毫升、0.4%酚紅水溶液3.5毫升。
所有材料低溫下用1NNaOH溶液校正其pH到7.4-7.6,Φ0.1微升分鐘ipore濾器過濾去除細菌和支原體後,分裝貯存於4℃冰櫃內備用。
二、豬肺炎支原體JS99株形態鑑定方法
瑞氏染色法鏡檢:塗片、固定、乾燥後,瑞氏染色,置顯微鏡下油鏡1600倍,可見分散的大量具有特定多形態的菌體。
三、豬肺炎支原體JS99株微粒凝集反應試驗鑑定方法
1.微粒凝集反應的原理:用一定比例的已知抗體血清與待檢培養抗原結合,會發生抗原—抗體凝集反應。由於此種支原體形小、凝集團塊肉眼不易察見,經塗片染色,在顯微鏡下放大觀察,可清晰地區別微粒凝集反應與非微粒凝集反應。有凝集反應可判斷培養抗原為豬肺炎支原體。
2.材料準備:
(1)抗原:豬肺炎支原體JS99株純粹培養物接種於江蘇2號培養基(KM2pH7.4),37℃培養48—72小時,待pH降至6.8左右,並有均勻一致的輕微混濁時,塗片染色鏡檢。可見分布均勻而純粹的大量具有特定性多形態菌體,以此培養物作為微粒凝集反應抗原。
(2)J株對照抗原、標準陽性血清及標準陰性血清,由江蘇省農科院畜牧獸醫研究所豬病研究室提供。血清須無菌並在56℃水浴中30分鐘滅能。
(3)江蘇2號(KM2)培養基。
(4)瑞氏(Wright’s)染色液。
3.操作方法:
(1)用不加陰性豬血清pG7.2的KM2培養基將J株對照抗原、待鑑定培養抗原作10倍稀釋。
(2)取稀釋抗原0.8毫升,加滅活的標準陽性血清及標準陰性血清0.2毫升混合於滅菌小玻瓶中(可用10毫升鏈黴素瓶代替),用滅菌橡皮塞塞緊,於37℃中培養48小時後塗片。置37℃溫箱內乾燥後,用甲醇固定乾燥後用瑞氏染色液染色,染色時間視氣溫高低而定夏季3—5分鐘,冬、秋季15—20分鐘;用蒸餾水沖洗乾淨、乾燥後,置顯微鏡下油鏡1000—1600倍以上,觀察記錄照相。
(3)該試驗均應無菌操作。
4.判定結果:在顯微鏡油鏡觀察下,如支原體顯示均勻一致的分布,定為無凝集反應(—);呈現小部分菌體凝集反應為(+);大部分菌體凝集反應(++);全部菌體凝集反應(+++)。J株對照抗原與陽性血清有++凝集反應,與陰性血清無凝集反應。豬肺炎支原體JS99株待鑑定培養抗原與陽性血清有++以上凝集反應。
5.說明:
(1)該法操作簡便,特異性高,可作為實驗室診斷鑑定的方法。
(2)套用此法鑑定豬支原體菌株,並證明:豬肺炎支原體JS99株與J株屬於同一種。
(3)在實驗室與豬鼻支原體、豬滑液支原體、萊氏不需膽甾支原體的高免兔血清作微凝反應,無交叉反應。
四、權利要求書所述之豬肺炎支原體JS-99株的P46基因鑑定試驗結果
P46基因是編碼Mhp細胞表面46KDa蛋白抗原的基因,該抗原可引起Mhp感染豬早期特異性免疫反應。該報告通過對弱毒MhpJS-99株P46基因的克隆測序,為MhpJS-99株的鑑定作分子標記。
1.材料與方法
1.1Mhp菌株與培養條件:MhpJS-99株培養物培養方法:培養基為km2培養基(製備方法略),種子繼代復壯後,1:10比例接種,37℃培養72小時,培養物pH由7.6降到6.8~6.6,並呈均一混濁狀態,無沉澱。培養物塗片瑞氏染色鏡檢,呈特異多形態菌體,無雜菌。培養物稀釋作液體培養變色單位(colourchangeunitccu)檢測MhpJS-99株濃度為10(7)~10(8)ccu/毫升。
1.2PCR引物的設計:從Internet下載Futo(1996)在GenBank登載的J株(ATCC25934)P46基因(命名:MYC46KDSA,1740bpDNA序列),該序列187~192為-10序列,222~230為RBS序列,235~1494為編碼P46抗原蛋白的CDS。用Goldkey軟體修正各種PCR產物設計指標,最終在320~1680獲得一對引物,在此區間內模板序列無HindIII、BamHI酶切位點,根據克隆質粒pUC19polylink酶切位點的要求,在引物5′和3′分別添加了HindIII和BamHI酶切位點及3個保護性鹼基,引物G+C%為53~56,無髮夾和二聚體,其序列為:(3′為反向互補)5′:GGCAAGCTTCAGGTTGTAGACAGACAG,3′:ACCGGATCCGTCACATCAGAAAGAGC。
1.3PCR模板的製備:MhpJS-99株培養物100毫升經0.05摩爾pH7.2PBS離心、洗滌3次後,沉澱以1毫升PBS懸浮。Mhp染色體DNA用BoehringerManuheim公司的HighpurePCRTemplatepreparationKit提純:吸取200微升Mhp懸液,加200微升結合緩衝液(含6Mguanidine-HCL,10mMurea,10mMTris-HCL,20%TritonX-100(v/v),pH4.4(25℃)),40微升蛋白酶k溶液(90毫克凍乾蛋白酶k溶於4.5毫升重蒸水,-20℃保存),立即混勻,72℃溫育10分鐘,再加100微升異丙醇,混合後反應液移入帶兩層玻璃纖維絨(吸附DNA用)的聚丙烯管,8000rpm1分鐘離心,棄液體。管中再加500微升沖洗液(含20mMNaCl,2mMTris-HCL,80%乙醇(v/v),25℃pH7.5),離心棄沖洗液,再重複沖洗後,加200微升預熱到70℃的DNA洗脫緩衝液(10mMTris,pH8.5,25℃),8000rpm離心1分鐘,收集Mph染色體DNA洗脫液,Backman毛細管紫外檢測儀測得洗脫DNA濃度為6ng/微升,可作PCR模板用。
1.4PCR擴增:引物由中科院上海植生所合成,每管為1個OD值,5′、3′引物分別含0.00370、0.00384μMDNA。分別加123、5微升、128、2微升滅菌重蒸水溶解,引物濃度均成為30pM/微升。TaqDNA聚合酶及緩衝液為Promega公司產,產品號C0010,濃度5u/微升,10X緩衝液含有:500mMkcl,100mMTris-HCL(pH9.0),1%TritonX100,15mMMgcl2。dNTP,Promega公司產,含dATP、dGTP、dCTP、dTTP各2.5mM/微升。
PCR擴增儀:PerkinElmerDNAThormelcycler。擴增條件設定為:預變性:96℃8分鐘;94℃1分鐘,45℃1分鐘,72℃3分鐘,循環35次;延伸:72℃10分鐘。
PCR擴增:在0.5毫升eppendorf管內分別加入:模板2微升,5′引物2微升,3′引物2微升,10×緩衝液5微升,dNTP4微升,滅菌重蒸水35微升,總體積為50微升。加20微升滅菌石臘油後,96℃變性8分鐘,冷卻確至室溫後,迅速在反應液中加入1微升TaqDNA聚合酶,繼續進行循環和延伸反應,擴增產物以1%的瓊脂糖電泳測定。
1.5電泳與照相:PCR產物10微升加2微升6×凝膠加樣緩衝液(0.25%溴酚藍,4%(w/v)蔗糖水溶液,300mMNaoH,6mM/LEDTA),在1%瓊脂糖凝膠上按《分子克隆》方法電泳。電泳儀為Mupid-2微型DNA電泳儀(CosmoBioCo.LTD.生產),按8~10v/cm電泳45分鐘,凝膠在溴化乙錠(0.5微克/毫升,pH8.0,1×TAE)中染色30~45分鐘,紫外燈下檢查。凝膠相片拍攝和條帶分析用KodakDigitalScience1D系統,標準分子量參照系用寶靈曼公司的1kbDNALadder。
1.6電泳產物回收:PCR產物電泳後,用1%低融點(LMP)瓊脂糖回收(參照《分子克隆》)。LMP瓊脂糖塊加200微升pH8.0TE於65℃溫育5分鐘,瓊脂糖溶解後加入等量體積的蒸餾酚,混勻,12000rpm5分鐘離心,小心吸取上清,再等體積加入1:1(v/v)混合的酚、氯仿溶液,混勻,12000rpm5分鐘離心,再等體積加入氯仿抽提一次。最後吸出的水相加0.1體積3M/L乙酸鈉和2倍體積4℃的乙醇沉澱DNA,-20℃過夜。12000rpm10分鐘離心,棄上清,4℃75%乙醇小心漂洗沉澱,50微升重蒸水溶解,-20℃保存。
1.7P46基因PCR提純產物和PUC19質粒DNAHindIII、BamHI雙酶切和回收:在0.5毫升eppendorf管中進行:①P46基因雙酶切反應PCR提純產物32微升、BamHI10u/微升2微升、HindIII10u/微升2微升、BufferE10×4微升、反應總體積40微升②質粒Puc19雙酶切反應pUC190.5微克/微升、10微升BamHI10u./微升2微升、HindIII10u./微升2微升、BufferE4微升、滅菌重蒸水22微升、反應總體積40微升。37.5℃反應45分鐘,產物按1.6方法電泳回收。
1.8連線反應:Puc19回收液13微升、PCR產物酶切回收液36微升、T4DNA連線酶1u./微升5微升、10X連線酶緩衝液6微升、反應總體積60微升。
16~20℃連線12hr,取出其中的10微升轉化感受態細胞。
1.9轉化、篩選重組子按常規方法製備大腸桿菌JM105株的感受態細胞,將含60微升新鮮感受態細胞的eppendorf管置冰水中,加入1.8連線反應產物10微升,冰水中放置30分鐘,再於42℃水浴2分鐘,加入1毫升LB,37℃振盪培養1hr,稍加離心,去上清,約餘500微升。吸200微升塗布接種含有氨苄青黴素和已塗布40微升X-gal貯存液(20毫克/毫升二甲基甲醯胺、4微升異丙基硫代-β-D-半乳糖苷(IPTG)溶液(200毫克/毫升))作選擇性標記的瓊脂培養皿上,靜置10分鐘後,倒置平板37℃培養18小時,挑選白色單菌落,再接種於含100μg/毫升氨苄青黴素的LB培養管,37℃振盪培養8hr,提取質粒。1.10重組子質粒的鑑定提取的重組子質粒10微升按1.7中pUC19質粒雙酶切反應的方法以BamHI、HindIII雙酶切,酶切後電泳檢查。1.11克隆基因的測序中科院上海植生所進行,用酶法螢光分析系統測序,以P46基因5′PCR引物為寡核苷酸引物。
2.結果
2.1MhpJS-99株模板DNA的提取用石英毛細管吸取5~8微升模板DNA提取液,在BackmanDU-600spctrophotometer上測得OD260為0.12,OD280為0.06,OD260/OD280=2.0,證明核酸純度較高,模板DNA濃度為:0.12×50=6ng/微升。
2.2P46基因的PCR擴增PCR產物以1%瓊脂糖凝膠電泳,電泳結果經KodakDigitalScience1D照相分析,目的基因為1.37kb,與設計期待長度1377bp相一致,PCR產物濃度為0.025μg/毫升。
2.3重組質粒的酶切鑑定重組質粒經BamHI、HindIII雙酶切後產生2.6kb、1.4kb兩條帶,酶切結果表明約1.37kb的P46基因已插入pUC19。
2.4克隆基因的部分測序及序列分析
測序結果與J株P46基因序列及鹼基組成比較結果如下:
P:鹼基缺失。
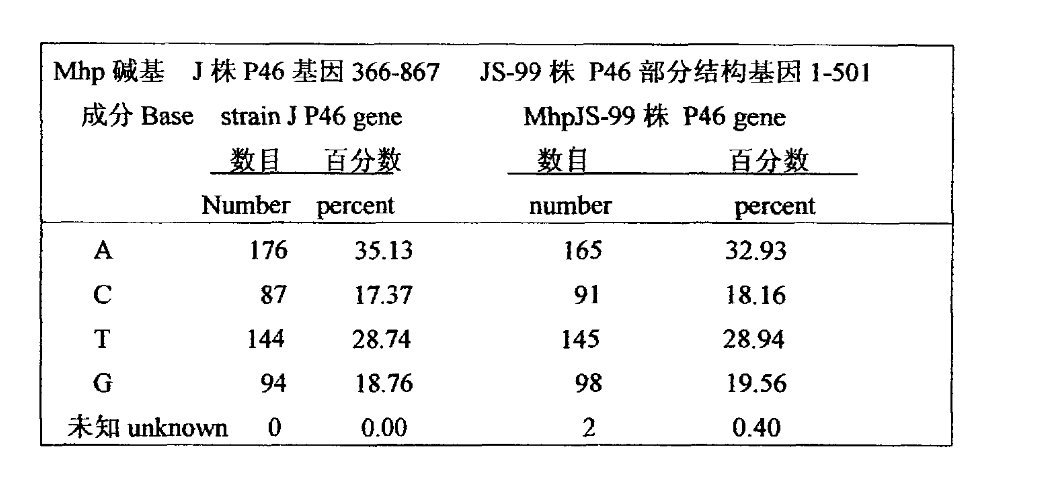
表1.MhpJS-99株P46基因鹼基組成與J株的比較
比較J株和MhpJS-99株P46基因的部分結構基因的10~490鹼基,(J株位於376~857),在10~385位鹼基均相同,僅在202位J株基因由G變為A,在385~490之間有14處變異,分別為5個A缺失,5個A變為C,1個A變為T,1個G變為T,2個T缺失。總體上A、T的缺失或變異占87%。比較J株(366-867)和MhpJS-99株P46基因(1-501)的鹼基成分,J株G+C%為36.13,MhpJS-99株為37.72,後者略多。MhpJS-99株P46基因的測序,可為MhpJS-99株的鑑定作分子標記。
榮譽表彰
2015年11月27日,《豬肺炎支原體克隆致弱株》獲得第十七屆中國專利獎優秀獎。

