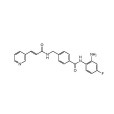
西達本胺,是一種有機化合物,化學式為C22H19FN4O2,臨床上適用於既往至少接受過一次全身化療的復發或難治的外周T細胞淋巴瘤(PTCL)患者。
基本介紹
- 中文名:西達本胺
- 外文名:Chidamide
- 別名:幾丁胺
- 化學式:C22H19FN4O2
- 分子量:390.410
- CAS登錄號:743420-02-2
- 密度:1.336 g/cm
- 沸點:600.2 ℃
- 閃點:316.8 ℃
- 折射率:1.691
西達本胺,是一種有機化合物,化學式為C22H19FN4O2,臨床上適用於既往至少接受過一次全身化療的復發或難治的外周T細胞淋巴瘤(PTCL)患者。
西達本胺,是一種有機化合物,化學式為C22H19FN4O2,臨床上適用於既往至少接受過一次全身化療的復發或難治的外周T細胞淋巴瘤(PTCL)患者。適應症1.用於既往至少接受過一次全身化療的復發或難治的外周T細胞淋巴瘤(P...
章胺 章胺是2008年公布的生物化學與分子生物學名詞。定義 學名:對羥基苯乙醇胺。酪氨酸經腸菌腐敗而脫羧產生的酪胺,進一步在體內經β羥化而生成。結構類似兒茶酚胺,作為假神經遞質可干擾兒茶酚胺功能而產生腦功能障礙。出處 《生物化學與分子生物學名詞》。
西達本胺片,西達本胺片適用於既往至少接受過一次全身化療的復發或難治的外周T細胞淋巴瘤(PTCL)患者。該適應症是基於一項單臂臨床試驗的客觀緩解率結果給予的有條件批准。有關本品用藥後長期生存方面的獲益尚未得到證實,隨機對照設計的確證性臨床試驗正在進行中。.成份 本品主要成份為西達本胺。性狀 本品為類白色片...
本書主要介紹了靶點藥物組蛋白去乙醯化酶(HDAC)抑制劑,HDAC抑制劑是近年熱門的表觀遺傳學機制新靶點抗腫瘤藥,2014年以來有3個藥物上市,其中包括中國自主研發的重量級創新藥西達本胺。本叢書旨在通過對已上市藥物的臨床前研究試驗和數據的總結和歸納,並通過表格、圖表等形式一目了然的呈現在讀者眼前。資料來源於...
深圳微芯藥業有限責任公司 深圳微芯藥業有限責任公司於2017年03月16日成立。法定代表人XIANPING LU,公司經營範圍包括:^原料藥(西達本胺),片劑、硬膠囊劑(均為抗腫瘤類)的生產等。
Vemurafenib 240 4.67 戊柔比星 Valrubicin 241 4.68 西達本胺 Chidamide 243 4.69 西達尿苷 Cedazuridine 244 4.69.1 西達尿苷 Cedazuridine 244 4.69.2 地西他濱/西達尿苷 Decitabine/Cedazuridine 245 4.70 鹽酸安羅替尼 Anlotinib hydrochloride 247 4.71 鹽酸尼洛替尼 Nilotinib hydrochloride 248 ...
邱少敏,女,1960年11月出生,主任醫師,腫瘤一科主任,1984年畢業於南通醫學院醫療系,學士學位。個人簡介 邱少敏從事腫瘤內科臨床工作二十餘年,發表論文十餘篇,2006年三氧化二砷治療大腸癌的實驗研究獲南京市科技進步三等獎。2007年新靶點藥物西達本胺治療大腸癌的實驗研究獲衛生局重點科題立項。現任中華醫學會江蘇省...
國家自然科學基金面上項目,82274027,HDAC1抑制劑西達本胺調控鐵死亡減輕癲癇認知障礙神經退變的機制研究,2023/01-2026/12,主持 國家自然科學基金面上項目,81974502,HIF1a-Lox-ERK-Alox5介導的鐵死亡新通路在癲癇發作中的作用機制及治療策略研究,2020/01-2023/12,主持 國家自然科學基金面上項目,81671293,Cx43...
微芯生物已被深圳市政府認定為自主創新行業龍頭企業、智慧財產權優勢企業和深圳市化學創新藥物工程技術中心。所獲榮譽 2018年12月9日,深圳微芯生物科技有限責任公司國家一類新藥西達本胺產業化項目被授予中國工業大獎提名獎。2020年3月18日,微芯生物以220億元人民幣市值位列《2020胡潤中國百強大健康民營企業》第68。
陸佩華,女,陸道培醫院醫療執行院長,北京陸道培血液病研究院院長。 部分論文 [1]張弦,張改玲,蘇雲超,石延澤,陸佩華.西達本胺聯合化療治療復發難治性急性白血病患者38例[J].中國新藥與臨床雜誌,2019,38(06):357-362.DOI:10.14109/j.cnki.xyylc.2019.06.009.[2]應志濤,張弦,宋玉琴,楊君芳,王小沛,鄭文,...
致使靶細胞死亡反應(壞死與凋亡)顯著放大;(5)EZH2受抑細胞中LC3、p62及Beclin1基因啟動子區相同DNA序列上H3K27me3富集降低與H4K16ac富集增加並存,強烈提示H3K27me3與H4K16ac的協同在EZH2抑制劑活化的細胞自噬過程中的重要作用;(6)丙戊酸鈉和廣譜HDAC抑制劑西達本胺(chidamide,抗T細胞淋巴瘤藥物)均能...
31.西達本胺治療T細胞淋巴瘤——臨床病例分析 32.精準醫療下——瀰漫大B細胞淋巴瘤預後評估與治療進展 33.霍奇金淋巴瘤的治療進展- 34.惡性淋巴瘤的免疫治療新進展 35.原髮結外DLBCL的治療進展 36.蛋白組學在急性髓細胞白血病研究及臨床套用進展 37.原發縱隔大B細胞淋巴瘤的疾病特點及最佳化治療 38.淋巴瘤...
西達本胺在晚期乳腺癌患者中的地位和套用 探路前方,且看mTOR和PI3K抑制劑如何逆轉內分泌耐藥 HER-2陽性乳腺癌雙靶-線治療再添中國證據 鳳凰涅檠:吡咯替尼10年研發歷程 當夢想照亮現實:三陰型乳腺癌免疫治療 IMpassion130研究第二次中期分析 乳腺癌腦轉移預後分析及放射治療策略 乳腺癌BRCA基因標準檢測和靶向治療...
09 西達本胺——打贏核心專利權保衛戰,劍指海外市場 10 安妥沙星和奈諾沙星——借鑑“他山之石”探索國產創新藥的制勝之道 11 阿利沙坦酯——銳意進取開拓創新繪製自主創新藥專利藍圖 12 左奧硝唑——問題導向的改良型創新實踐成就裂變之路 13 帕拉米韋三水合物——外圍專利布局緊扣上市進程,從跟進到超越 14 ...
埃克替尼、阿帕替尼、西達本胺、康柏西普等15個1類創新藥獲得批准生產,29個創新醫療器械獲準上市。我國自主研發的利培酮緩釋微球、康柏西普眼用注射液等一批國產藥品在美歐已開發國家申請註冊進入國際市場;經皮介入人工心臟瓣膜系統、乳腺X射線數位化體層攝影設備、植入式迷走神經刺激脈衝發生器等等創新醫療器械達到了...
73.西達本胺 74.依維莫司 75.聚乙二醇化重組人粒細胞集落刺激因子 76.克唑替尼 77.雷替曲塞 78.氟維司群 79.阿瑞匹坦 附錄1 從身高及體重決定體表面積的計算圖表 附錄2 國家基本藥物目錄 (2012年版) 中抗腫瘤藥部分 附錄3 國家基本醫療保險、工傷保險和生育保險藥品目錄 (2009年版) 中抗腫瘤...
在“重大新藥創製”科技重大專項推動下,湧現出一批高質量創新成果,“十二五”期間210個創新藥獲批開展臨床研究,埃克替尼、阿帕替尼、西達本胺、康柏西普等15個1類創新藥獲批生產,110多個新化學仿製藥上市,中藥質量控制與安全性技術水平提升,PET-CT、128排CT等一批大型醫療設備和腦起搏器、人工耳蝸等高端植入介入...
深圳微芯生物科技有限責任公司:國家一類新藥西達本胺產業化項目 廣船國際有限公司:極地甲板運輸船研製 滬東中華造船(集團)有限公司:17.2萬㎥液化天然氣(LNG)船研製 中國同輻股份有限公司:利用核電重水堆生產鈷60技術研發及產業化工程 武漢銳科光纖雷射技術股份有限公司:工業光纖雷射器及其套用 ...
