《製備艾瑞昔布的方法》是上海源力生物技術有限公司於2010年3月30日申請的專利,該專利的公布號為CN102206178A,授權公布日為2011年10月5日,發明人是張富堯、神小明、孫飄揚。
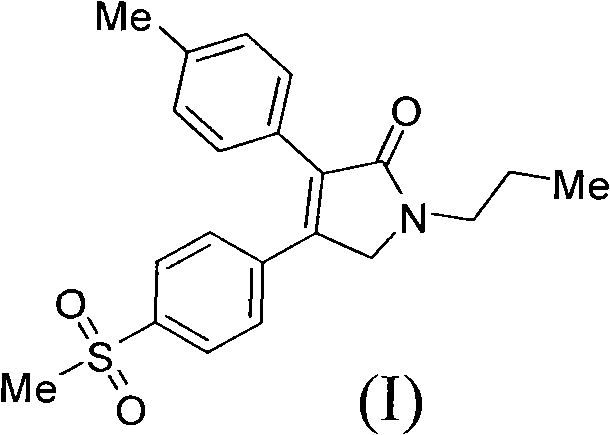
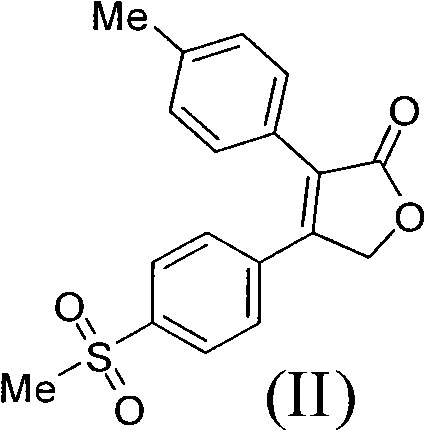
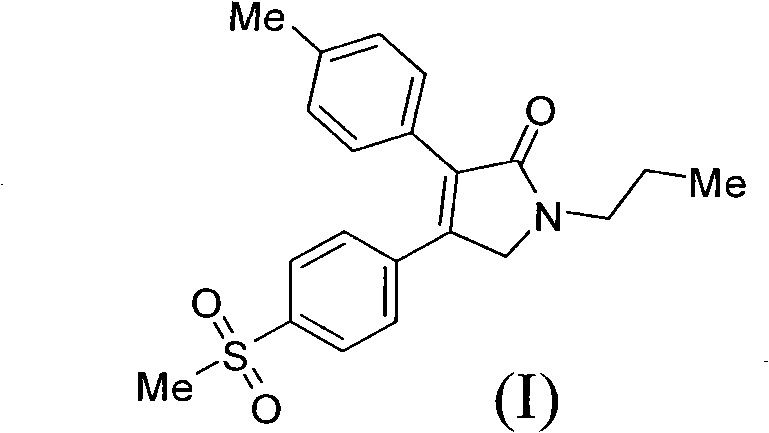
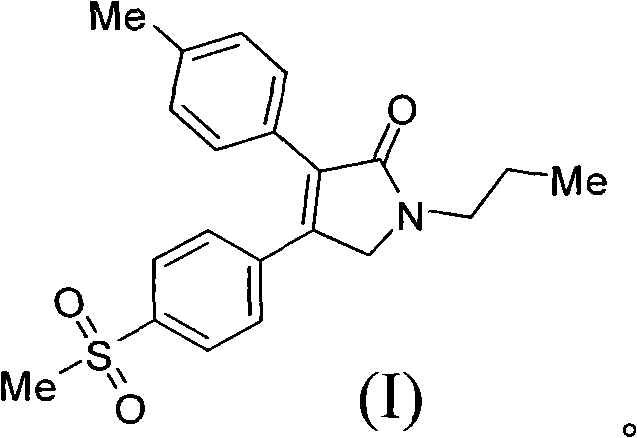
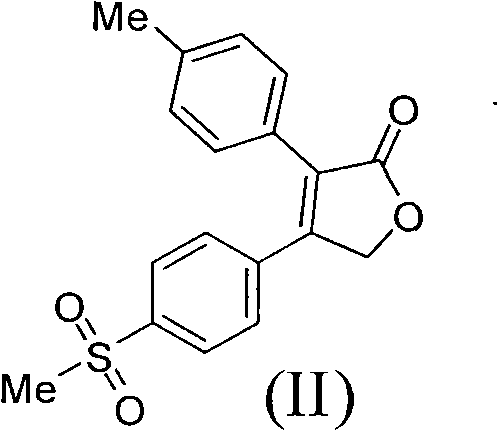
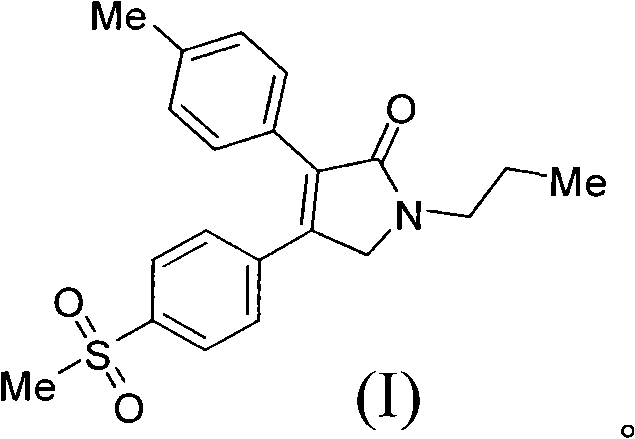
《製備艾瑞昔布的方法》涉及製備艾瑞昔布的方法,所述方法以甲磺醯苯乙酮為原料,通過合成二氫呋喃酮(結構式II),然後把二氫呋喃酮(II)轉化為吡咯烷酮從而製得艾瑞昔布(結構式I)。該製備方法的合成路線短,成本低,操作簡單,易於分離純化,適合於大規模生產。
2018年12月20日,《製備艾瑞昔布的方法》獲得第二十屆中國專利獎優秀獎。
基本介紹
- 中文名: 製備艾瑞昔布的方法
- 公告號:CN102206178A
- 授權日:2011年10月5日
- 申請號:2010101369763
- 申請日:2010年3月30日
- 申請人:上海源力生物技術有限公司
- 地址:上海市浦東新區張江高科技園區蔡倫路399號
- 發明人:張富堯、神小明、孫飄揚
- Int.Cl.:C07D207/38(2006.01)I
- 代理機構:北京戈程智慧財產權代理有限公司
- 代理人:程偉
- 類別:發明專利
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
艾瑞昔布(N-正丙基-3-對甲基苯基-4-對甲磺醯基苯基-3-吡咯烷-2-酮)是一種適度抑制COX-2的非甾體抗炎藥物,2010年3月前技術(US20040029951)中記載了艾瑞昔布的合成方法,包括以下步驟:
1)以甲磺醯苯乙酮為原料,經溴代製得α-溴代甲磺醯苯乙酮;
2)α-溴代甲磺醯苯乙酮的硼氫化鈉還原得到氧化苯乙烯衍生物;
3)氧化苯乙烯衍生物與正丙胺反應生成N-正丙基-β-羥基苯乙胺行生物;
4)對甲苯乙酸與過量的二氯亞碸反應生成對甲基苯乙醯氯;
5)對甲基苯乙醯氯與N-正丙基-β-羥基苯乙胺行生物反應生成N-正丙基-N-[2-羥基-2-對甲磺醯苯乙基]苯乙醯胺;
6)Jone’s試劑或吡啶三氧化鉻氧化N-正丙基-N-[2-羥基-2-對甲磺醯苯乙基]苯乙醯胺得到氧代苯乙醯胺行生物;
7)在鹼性介質作用下縮合上述氧代苯乙醯胺製得終產物艾瑞昔布。
由於2010年3月前製備方法路線較長,並且涉及還原,氧化,醯胺耦合等步驟,溶劑用量大,成本高,特別是氧化步驟中要用到Jone’s試劑或吡啶三氧化鉻等氧化劑,該氧化步驟產率低且產品不易分離純化,而且因為金屬鉻在原料藥中殘留量控制標準極其嚴格而難以控制,從而使得該製備方法難以適用於大規模生產。
發明內容
專利目的
《製備艾瑞昔布的方法》的目的在於提供一種簡單、經濟、安全的製備艾瑞昔布的方法,適於工業化大規模生產。
技術方案
《製備艾瑞昔布的方法》涉及一種製備抗炎藥物艾瑞昔布(結構式I)的製備方法,所述方法包括以甲磺醯苯乙酮為原料,通過中間體(III)和中間體(II)製備艾瑞昔布,
具體包括如下步驟:
1)以甲磺醯苯乙酮(IV)為原料,經溴代製得α-溴代甲磺醯苯乙酮(III);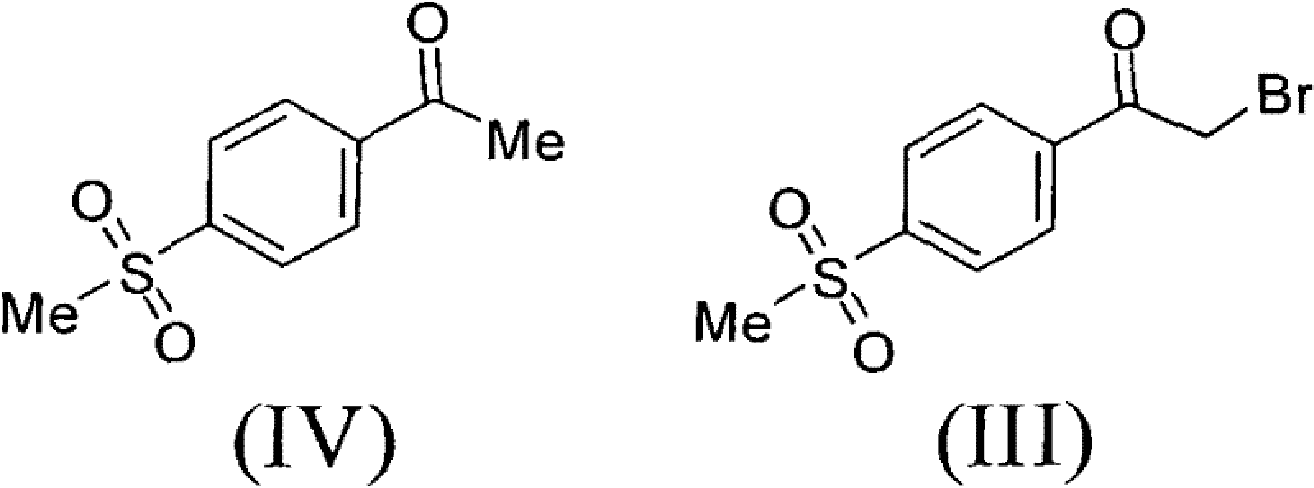

2)在鹼性介質作用下,化合物(III)與對甲苯乙酸縮合成環得到二氫呋喃酮(II),所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合,優選為Et3N;所述的反應溶劑選自DMF、THF,Me-THF、EtOH、乙腈、甲苯、丙酮或水的任一種或其組合,優選為乙腈;所述的反應溫度為20℃-80℃,優選為75℃;
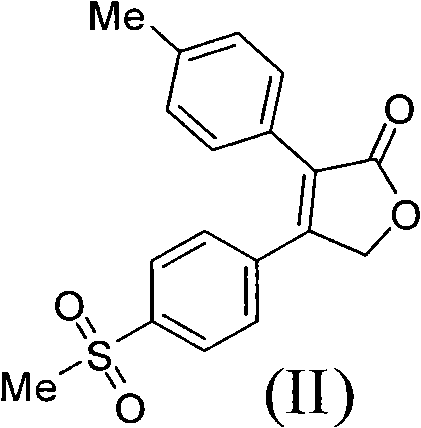
3)二氫呋喃酮(II)與正丙胺和正丙胺鹽反應生成吡咯烷酮從而製得艾瑞昔布,所述的正丙胺鹽選自正丙胺甲酸鹽、正丙胺醋酸鹽、正丙胺鹽酸鹽、正丙胺硫酸鹽、正丙胺磷酸鹽或正丙胺氫溴酸鹽的任一種或其組合,優選為正丙胺醋酸鹽;所述的反應溫度為120℃-170℃,優選為160℃。
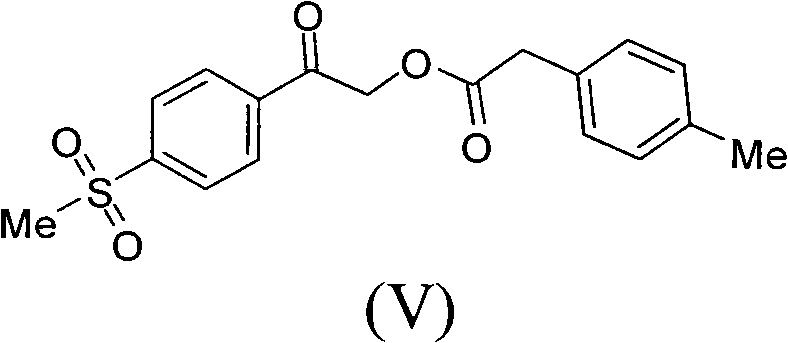
進一步,《製備艾瑞昔布的方法》還涉及另一種製備艾瑞昔布的製備方法,所述方法包括以甲磺醯苯乙酮為原料,通過中間體(III),中間體(V)和中間體(II)製備艾瑞昔布,
具體包括如下步驟:
1)以甲磺醯苯乙酮(IV)為原料,經溴代製得α-溴代甲磺醯苯乙酮(III);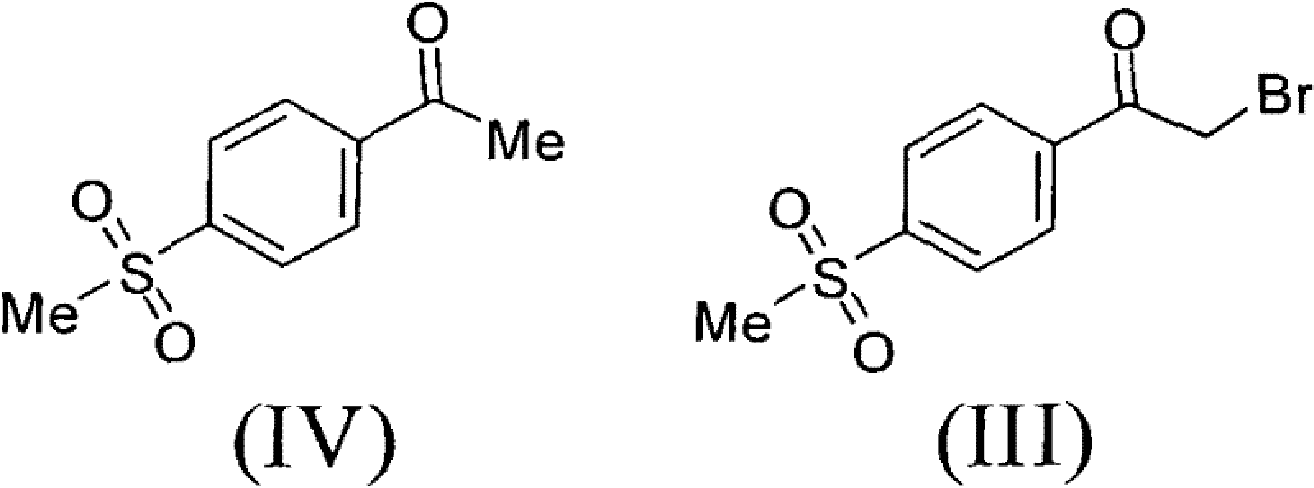

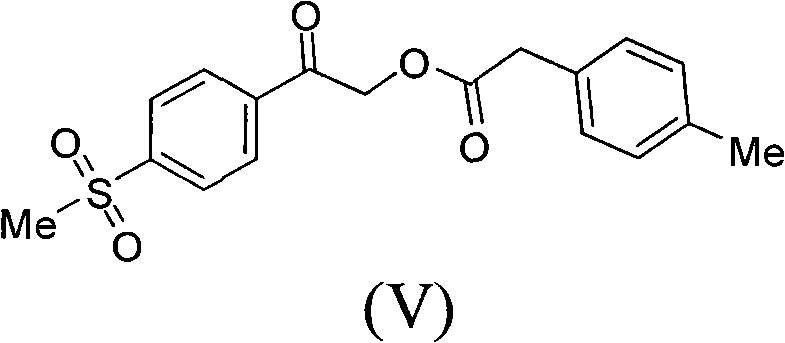
2)在鹼性介質作用下,化合物(III)與對甲苯乙酸縮合得到中間體(V),所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合,優選為Et3N;所述的反應溶劑選自DMF、THF、Me-THF、EtOH、乙腈、丙酮或水的任一種或其組合,優選為乙腈;
3)在鹼性介質作用下,化合物(V)縮合成環得到二氫呋喃酮(II),所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合,優選為Et3N;所述的反應溶劑選自DMF、THF、Me-THF、EtOH、乙腈、丙酮、異丙醇、正丁醇或水的任一種或其組合,優選為乙腈;所述的反應溫度為0℃-120℃,優選為75℃;
4)二氫呋喃酮(II)與正丙胺反應後,在酸性介質作用下,製得艾瑞昔布,所述的酸性介質選自甲酸、醋酸、鹽酸、硫酸、磷酸或氫溴酸的任一種或其組合,優選為醋酸;所述的反應溫度為50℃-120℃。
改善效果
《製備艾瑞昔布的方法》方法具有合成路線段,操作簡單,易於分離和純化,溶劑用量少,成本低、安全並適合工業化生產等特點,具有顯著的社會效益和經濟效益。
除非有相反陳述,在說明書和權利要求書中使用的英文縮寫具有下述含義。
Et3N | 三乙胺 |
DBU | 1,8-二氮雜雙環(5.4.0)十一-7-烯 |
TMG | N,N,N’,N’-四甲基胍 |
Py | 吡啶 |
DIPEA | 二異丙基乙基胺 |
K2CO3 | 碳酸鉀 |
KHCO3 | 碳酸氫鉀 |
Na2CO3 | 碳酸鈉 |
NaHCO3 | 碳酸氫鈉 |
KOH | 氫氧化鉀 |
NaOH | 氫氧化鈉 |
NaOMe | 甲醇鈉 |
NaOEt | 乙醇鈉 |
NaOBu | 叔丁醇鈉 |
NaH | 氫化鈉 |
DMF | N,N’-二甲基甲醯胺 |
THF | 四氫呋喃 |
Me-THF | 2-甲基四氫呋喃 |
EtOH | 乙醇 |
技術領域
《製備艾瑞昔布的方法》涉及取代的吡咯烷酮的製備方法,特別涉及艾瑞昔布的製備方法。
權利要求
1.一種製備艾瑞昔布的方法,其特徵在於,其包括如下步驟:
1)以甲磺醯苯乙酮(IV)為原料,經溴代製得α-溴代甲磺醯苯乙酮(III);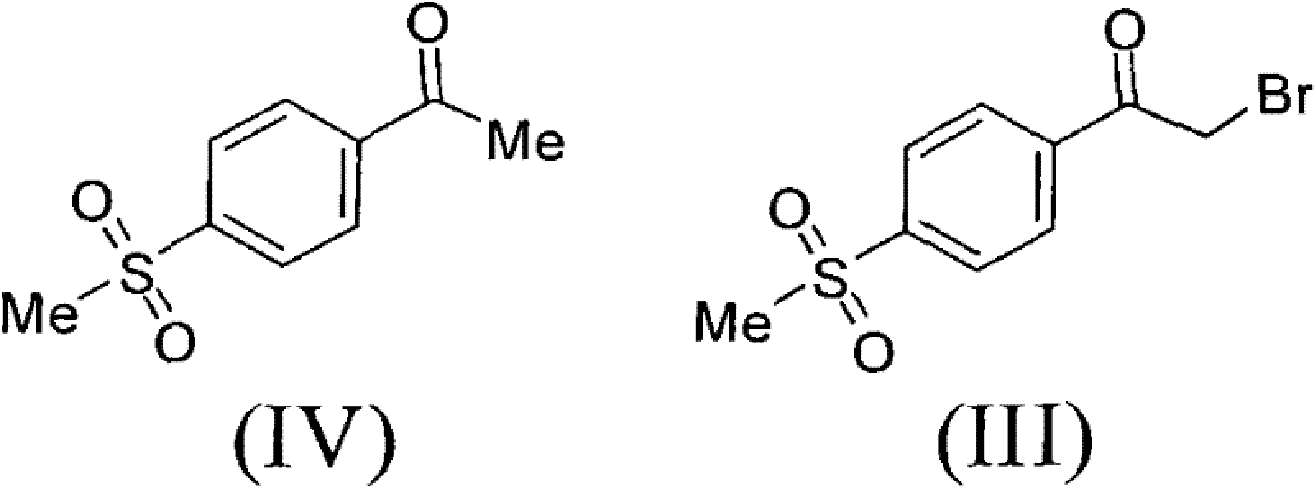

2)在鹼性介質作用下,化合物(III)與對甲苯乙酸縮合成環得到二氫呋喃酮(II);
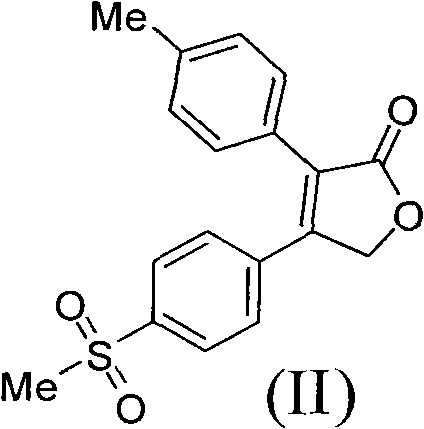
3)二氫呋喃酮(II)與正丙胺和正丙胺鹽反應生成吡咯烷酮從而製得艾瑞昔布(I)
2.根據權利要求1所述的製備艾瑞昔布的方法,其特徵在於,在步驟2)中,所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合;所述的反應在溶劑中進行,所述的溶劑選自DMF、THF、Me-THF、EtOH、乙腈、甲苯、丙酮或水的任一種或其組合;所述的反應在溫度20℃-80℃進行。
3.根據權利要求2所述的製備艾瑞昔布的方法,其特徵在於,在步驟2)中,所述的鹼性介質為Et3N;所述的反應溶劑為乙腈;所述的反應在溫度75℃進行。
4.根據權利要求1所述的製備艾瑞昔布的方法,其特徵在於,在步驟3)中,所述的正丙胺鹽選自正丙胺甲酸鹽、正丙胺醋酸鹽、正丙胺鹽酸鹽、正丙胺硫酸鹽、正丙胺磷酸鹽或正丙胺氫溴酸鹽的任一種或其組合,優選為正丙胺醋酸鹽。
5.根據權利要求1所述的製備艾瑞昔布的方法,其特徵在於,在步驟3)中,所述的反應在溫度120℃-170℃進行,優選在溫度160℃進行。
6.一種製備艾瑞昔布的方法,其特徵在於,
其包括如下步驟:
1)以甲磺醯苯乙酮(IV)為原料,經溴代製得α-溴代甲磺醯苯乙酮(III);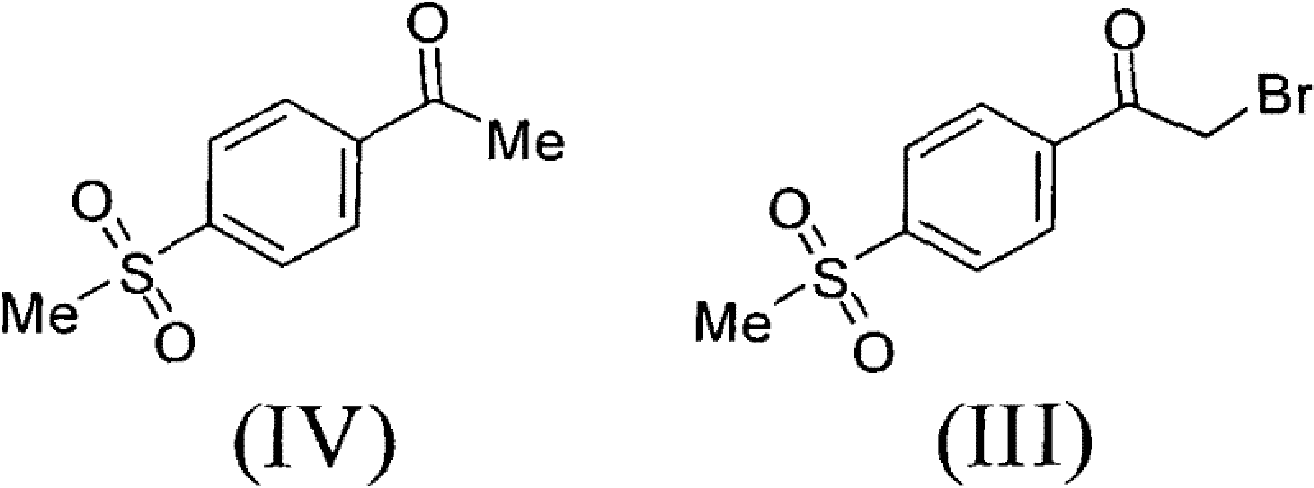

2)在鹼性介質作用下,化合物(III)與對甲苯乙酸縮合得化合物(V);
3)在鹼性介質作用下,化合物(V)縮合成環得到二氫呋喃酮(II);
4)二氫呋喃酮(II)與正丙胺反應後,在酸性介質作用下,製得艾瑞昔(I)
7.根據權利要求6所述的製備艾瑞昔布的方法,其特徵在於,在步驟2)中,所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合;所述的反應在溶劑中進行,所述的溶劑選自DMF、THF、Me-THF、EtOH、乙腈、丙酮或水的任一種或其組合。
8.根據權利要求7所述的製備艾瑞昔布的方法,其特徵在於,在步驟2)中,所述的鹼性介質為Et3N;所述的反應溶劑為乙腈。
9.根據權利要求6所述的製備艾瑞昔布的方法,其特徵在於,在步驟3)中,所述的鹼性介質選自Et3N、DBU、TMG、Py、DIPEA、K2CO3、KHCO3、Na2CO3、NaHCO3、KOH、NaOH、NaOMe、NaOEt、NaOBu或NaH的任一種或其組合;所述的反應在溶劑中進行,所述的溶劑選自DMF、THF,Me-THF、EtOH、乙腈、丙酮、異丙醇、正丁醇或水的任一種或其組合;所述的反應在溫度0℃-120℃進行。
10.根據權利要求9所述的製備艾瑞昔布的方法,其特徵在於,在步驟3)中,所述的鹼性介質為Et3N;所述的反應溶劑為乙腈;所述的反應在溫度為75℃進行。
11.根據權利要求6所述的製備艾瑞昔布的方法,其特徵在於,在步驟4)中,所述的酸性介質選自甲酸、醋酸、鹽酸、硫酸、磷酸,或氫溴酸的任一種或其組合;所述的反應在溫度50℃-120℃進行。
12.根據權利要求11所述的製備艾瑞昔布的方法,其特徵在於,在步驟4)中,所述的酸性介質為醋酸。
實施方式
- 實施例1:製備艾瑞昔布(合成路線1)
合成路線1
步驟1)、製備α-溴代甲磺醯苯乙酮(III)
將51.0克4-甲磺醯基苯乙酮和760毫升醋酸加到帶有磁力攪拌,溫度計和恆壓滴液漏斗的1000毫升三口玻璃燒瓶中。加熱到40℃,開始緩慢滴加41.1克液溴,滴加完後,繼續在40℃攪拌30分鐘。反應液在50℃濃縮後,加入水,攪拌,過濾,水洗,烘乾,得到70.5克粗產品,加乙酸乙酯/正己烷混合溶劑,加熱回流1小時,緩慢冷卻到25℃,過濾烘乾得56.5克類白色固體α-溴代甲磺醯苯乙酮(III),收率80.0%。
H-NMR(CDCl3,TMS,400MHz):3.120(3H,s),4.485(2H,s),8.101(2H,dd,J=2.0Hz),8.191(2H,dd,J=2.0Hz)
MS(M+1):279.05
步驟2)、製備4-(4-甲磺醯基苯基)-3-(4-甲基苯基)-2,5-二氫呋喃-2-酮(II)
實驗條件A
將44.3克α-溴代甲磺醯苯乙酮(III),24.0克4-甲基苯乙酸和600毫升乙腈加到帶有磁力攪拌,溫度計和恆壓滴液漏斗的500毫升三口燒瓶中。通過恆壓滴液漏斗滴加入24.0毫升三乙胺,溫度控制在25℃,加完後,繼續攪拌1小時。再加入36.0毫升三乙胺,反應液加熱到75℃,攪拌反應18小時。降溫到25℃,濃縮,加入乙酸乙酯,水洗,有機相濃縮後加入乙酸乙酯和乙醇,攪拌,過濾得到28.0克淺黃色固體化合物(II),收率53.4%。
H-NMR(CDCl3,TMS)2.398(3H,s),3.091(3H,s),5.192(2H,s),7.216(2H,d,J=8.0Hz),7.292(2H,d,J=8.0Hz),7.543(2H,d,J=8.0Hz),7.933(2H,d,J=8.0Hz)
MS(M+1):329.02
類似地,化合物(II)可在實驗條件B、C、D下製備得到。
實驗條件B
將5.0克α-溴代甲磺醯苯乙酮(III),2.7克4-甲基苯乙酸和70毫升乙腈加到帶有磁力攪拌,溫度計和恆壓滴液漏斗的100毫升三口燒瓶中。通過恆壓滴液漏斗滴加入2.3毫升四甲基胍,溫度控制在20℃,加完後,繼續攪拌1.5小時。再加入4.6毫升四甲基胍,20℃攪拌反應2小時。濃縮,加入乙酸乙酯,水洗,有機相濃縮後加入乙酸乙酯和乙醇,攪拌,過濾得到2.5克淺黃色固體化合物(II),收率42.0%。
實驗條件C
將1.85克α-溴代甲磺醯苯乙酮(III),1.0克4-甲基苯乙酸和20毫升乙醇加到帶有磁力攪拌,溫度計和恆壓滴液漏斗的50毫升三口燒瓶中。通過恆壓滴液漏斗滴加入1.0毫升三乙胺,溫度控制在25℃,加完後,繼續攪拌3小時。再加入2.0毫升三乙胺,80℃攪拌反應18小時。濃縮,加入乙酸乙酯,水洗,有機相濃縮後加入乙酸乙酯和乙醇,攪拌,過濾得到0.83克淺黃色固體化合物(II),收率38.1%。
實驗條件D
將1.0克α-溴代甲磺醯苯乙酮(III),0.54克4-甲基苯乙酸和12毫升乙腈加到帶有磁力攪拌,溫度計和恆壓滴液漏斗的50毫升三口燒瓶中。加入1.0克碳酸鉀,25℃反應2小時。然後50℃攪拌反應5小時。濃縮,加入乙酸乙酯,水洗,有機相濃縮後加入乙酸乙酯和乙醇,攪拌,過濾得到0.13克淺黃色固體化合物(II),收率11%。
步驟3)、製備N-正丙基-3-對甲基苯基-4-對甲磺醯基苯基-3-吡咯烷-2-酮(艾瑞昔布(I))
實驗條件A
將25.0毫升正丙胺,在10℃滴加到17.5毫升醋酸中,加完後攪拌,向生成的正丙胺醋酸鹽中加入10.0克化合物(II)。氮氣保護下,加熱到160℃,攪拌反應8小時。降溫到40℃,加入二氯甲烷和水,靜置分層。有機相濃縮後殘留物中加入乙醇,加熱回流,降溫到25℃,過濾,烘乾得到8.2克白色固體產品化合物(I),收率72.8%。
H-NMR(CDCl3,TMS,400MHz)1.008(3H,t,J=7.2Hz),1.701-1.756(2H,m),2.376(3H,s),3.078(3H,s),3.575(2H,t,J=7.2Hz),4.317(2H,s),7.175(2H,d,J=8.0Hz),7.294(2H,d,J=8.0Hz),7.505(2H,t,J=6.8Hz),7.870(2H,t,J=6.8Hz)
MS(M+1):370.17
類似地,化合物(I)可在實驗條件B、C、D下製備得到。
實驗條件B
將2.9克正丙胺鹽酸鹽和1.0克化合物(II)混合,氮氣保護下,加熱到170℃,攪拌反應2小時。降溫到40℃,加入二氯甲烷和水,靜置分層。有機相濃縮後殘留物中加入乙醇,加熱回流,降溫到25℃,過濾,烘乾得到0.9克白色固體產品化合物(I),收率80.0%。
實驗條件C
將2.0克化合物(II),3毫升正丙胺,1.75克正丙胺鹽酸鹽加入氮氣保護的封管中,加熱至140℃,反應20小時。冷卻至室溫,加入二氯甲烷和水,靜置分層。有機相濃縮後殘留物中加入乙醇,加熱回流,降溫到25℃,過濾,烘乾得到1.8克白色固體產品化合物(I),收率80.0%。
實驗條件D
將0.5毫升正丙胺,在10℃滴加到0.35毫升醋酸中,加完後攪拌,向生成的正丙胺醋酸鹽中加入0.5克化合物(II)。氮氣保護下,加熱到120℃,攪拌反應4小時。降溫到40℃,加入二氯甲烷和水,靜置分層。有機相濃縮純化後得到0.14克化合物(I),收率24.2%。
- 實施例2:製備艾瑞昔布(合成路線2)

合成路線2
步驟1)、製備α-溴代甲磺醯苯乙酮(III)
方法同實施例1中步驟1)
步驟2)、製備2-(4-甲磺醯基苯基)-2-氧代乙基2’-(4-甲基苯基)-乙酸酯(V)
實驗條件A
將10.0克α-溴代甲磺醯苯乙酮(III),5.4克4-甲基苯乙酸和50毫升乙腈加入到100毫升的三口反應瓶中。滴加入5.4毫升三乙胺,25℃攪拌2小時。加入150毫升乙酸乙酯,用水洗有機相,有機相濃縮乾,加入240毫升乙腈,得到中間體(V)的乙腈溶液(HPLC97.6%),無需分離直接做下步操作。
H-NMR(CDCl3,TMS,400MHz)2.362(3H,s),3.097(2H,s),3.792(2H,s),5.343(2H,s),7.163-7.285(4H,m),8.065(4H,s)
MS(M+1):346.18
類似地,化合物(V)可在實驗條件B、C下製備得到。
實驗條件B
將10.0克α-溴代甲磺醯苯乙酮(III),5.4克4-甲基苯乙酸和50毫升乙腈加入到100毫升的三口反應瓶中。滴加入13.6毫升四甲基胍,25℃攪拌1.5小時。加入150毫升乙酸乙酯,有機相濃縮乾,加入240毫升乙腈,得到中間體(V)的乙腈溶液(HPLC89.0%),無需分離直接做下步操作。
實驗條件C
將10.0克α-溴代甲磺醯苯乙酮(III),5.4克4-甲基苯乙酸和50毫升丙酮加入到100毫升的三口反應瓶中。滴加入5.4毫升三乙胺,25℃攪拌1小時。加入150毫升乙酸乙酯,用水洗有機相兩次,有機相濃縮乾,加入240毫升乙腈,得到中間體(V)的乙腈溶液(HPLC98.0%),無需分離直接做下步操作。
步驟3)、製備4-(4-甲磺醯基苯基)-3-(4-甲基苯基)-2,5-二氫呋喃-2-酮(II)
實驗條件A
向中間體(V)的乙腈溶液中加入20毫升三乙胺,80℃反應20小時,冷卻到15-20℃,反應液直接濃縮到近乾,加入乙酸乙酯和水,分出有機相,濃縮後,加入乙醇和乙酸乙酯,攪拌,過濾,烘乾得到7.3克淺黃色固體化合物(II),收率55%。
化合物II:H-NMR(CDCl3,TMS)2.398(3H,s),3.091(3H,s),5.192(2H,s),7.216(2H,d,J=8.0Hz),7.292(2H,d,J=8.0Hz),7.543(2H,d,J=8.0Hz),7.933(2H,d,J=8.0Hz)
MS(M+1):329.02
類似地,化合物(II)可在實驗條件B、C、D、E、F下製備得到。
實驗條件B
將2.0克中間體(V),加入50毫升乙醇和1.6毫升三乙胺,75℃反應20小時,冷卻到15-20℃,反應液直接濃縮到近乾,加入乙酸乙酯和水,分出有機相,濃縮後,加入乙醇和乙酸乙酯,攪拌,過濾,烘乾得到0.98克淺黃色固體化合物(II),收率52%。
實驗條件C
將2.0克中間體(V),加入50毫升乙腈和1.5毫升四甲基胍,75℃反應1小時,冷卻到15-20℃,反應液直接濃縮到近乾,加入乙酸乙酯和水,分出有機相,濃縮後,加入乙醇和乙酸乙酯,攪拌,過濾,烘乾得到0.85克淺黃色固體化合物(II),收率45%。
實驗條件D
將2.0克中間體(V),加入50毫升正丁醇和1.9毫升二異丙基乙胺,120℃反應20小時,冷卻到15-20℃,反應液直接濃縮到近乾,加入乙酸乙酯和水,分出有機相,濃縮後,加入乙醇和乙酸乙酯,攪拌,過濾,烘乾得到0.80克淺黃色固體化合物(II),收率42%。
實驗條件E
將2.0克中間體(V),加入30毫升乙腈,降溫至0℃,滴加1.75克DBU乙腈溶液(10毫升),0℃反應15分鐘,加入乙酸乙酯和水,分出有機相,濃縮後,加入乙醇和乙酸乙酯,攪拌,過濾,烘乾得到1.9克淺黃色固體化合物(II),收率91%。
實驗條件F(步驟2和3合併)
向100克化合物(III)和54.2克4-甲基苯乙酸中加入500毫升乙腈,向混合物中滴加54毫升三乙胺,溫度不超過25℃,滴加完畢後15-20℃攪拌1.5小時。向反應液中加入乙酸乙酯,水洗。乙酸乙酯層濃縮後加入乙腈,得到中間體(V)的乙腈溶液。加入200毫升三乙胺。加熱至75℃,反應18小時。冷卻至室溫,濃縮。加入乙酸乙酯/乙醇,75℃攪拌30分鐘,冷卻至室溫,過濾,烘乾得到77克淺黃色固體化合物(II),收率72%。
步驟4):製備N-正丙基-3-對甲基苯基-4-對甲磺醯基苯基-3-吡咯烷-2-酮(艾瑞昔布(I))
實驗條件A
將5.0克化合物(II)和15.0毫升正丙胺加到反應瓶中,氮氣置換保護,加熱到65℃,反應4小時。冷到室溫,加入四氫呋喃,濃縮,加入15毫升醋酸,加熱到120℃,攪拌反應4小時,反應液降溫到20℃,加水,析出固體,過濾。得到的固體用乙醇重結晶,得到4.2克類白色固體化合物(I),收率75%。
化合物I(艾瑞昔布):H-NMR(CDCl3,TMS,400MHz)1.008(3H,t,J=7.2Hz),1.701-1.756(2H,m),2.376(3H,s),3.078(3H,s),3.575(2H,t,J=7.2Hz),4.317(2H,s),7.175(2H,d,J=8.0Hz),7.294(2H,d,J=8.0Hz),7.505(2H,t,J=6.8Hz),7.870(2H,t,J=6.8Hz)
MS(M+1):370.17
類似地,化合物(I)可在實驗條件B、C、D下製備得到。
實驗條件B
將100克化合物(II)和300毫升正丙胺加到反應瓶中,加熱到50℃反應3小時。冷到室溫,濃縮,加入500毫升醋酸,加熱到120℃,攪拌反應3小時,反應液降溫到20℃,加水,析出固體,過濾,乾燥,得到96.0克白色固體化合物(I),收率85%。
實驗條件C
將1.0克化合物(II)和3毫升正丙胺加到反應瓶中,加熱到50℃反應3小時。冷到室溫,濃縮,加入10毫升醋酸,加熱到60℃,攪拌反應18小時,反應液降溫到20℃,加水,析出固體,過濾,乾燥,得到0.8克白色固體化合物(I),收率70%。
實驗條件D
將1.0克化合物(II)和3毫升正丙胺加到反應瓶中,加熱到50℃反應3小時。冷到室溫,濃縮,加入10毫升85%磷酸,加熱到60℃,攪拌反應2小時,反應液降溫到20℃,加水,析出固體,過濾,乾燥,得到0.73克白色固體化合物(I),收率65%。
榮譽表彰
2018年12月20日,《製備艾瑞昔布的方法》獲得第二十屆中國專利獎優秀獎。

