大多數化學反應,其反應速率隨溫度升高而增加。通常認為溫度對濃度的影響可以忽略,因此反應速率隨溫度的變化體現在速率常數隨溫度的變化上。實驗表明,對於均相熱化學反應,反應溫度每升高10K,其反應速率變為原來的2~4倍,即
k(T+10K)/k(T)≈2~4
該式稱為范特霍夫規則。
基本介紹
- 中文名:范特霍夫規則
- 外文名:vant Hoff rule
- 提出者:范特霍夫
- 套用學科:化學
定律定義

實驗驗證
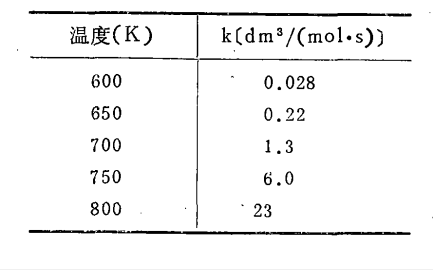

大多數化學反應,其反應速率隨溫度升高而增加。通常認為溫度對濃度的影響可以忽略,因此反應速率隨溫度的變化體現在速率常數隨溫度的變化上。實驗表明,對於均相熱化學反應,反應溫度每升高10K,其反應速率變為原來的2~4倍,即
k(T+10K)/k(T)≈2~4
該式稱為范特霍夫規則。


范特霍夫根據大量實驗事實,提出一個經驗規則:溫度每上升10°C,反應速率提高2~4倍。該式稱為范特霍夫規則。式中,kt、kt+10和kt+10n為溫度t°C、(t+10)°C...
6.4.1 范特霍夫規則6.4.2 阿侖尼烏斯方程6.4.3 指前因子k06.4.4 阿侖尼烏斯活化能6.5 複合反應6.5.1 平行反應6.5.2 對行反應...
3.2.5范特霍夫規則77 3.2.6阿倫尼烏斯原理77 3.2.7基元反應的微觀可逆性原理77 3.2.8活化能的計算方法78 3.2.9處理複雜反應的近似方法79 3.2.10基元...
一、范特霍夫規則二、阿累尼烏公式三、活化能第五節 催化作用及其特徵、酶催化一、催化作用的特性二、酶催化的特性及其套用附錄附錄Ⅰ 《中華人民共和國法定計量...
8.4.1范特霍夫規則——k-T關係的近似經驗式2878.4.2阿倫尼烏斯方程——k-T關係的準確經驗式2878.4.3化學反應的活化能2898.5典型複合反應291...
一、范特霍夫規則153二、阿倫尼烏斯方程154三、活化能156四、反應的適宜溫度157第四節複合反應157一、對峙反應157二、平行反應159 [1] ...
一、范特霍夫規則278二、阿倫尼烏斯方程278三、活化能280第四節典型複合反應281一、對峙反應281二、平行反應283三、連串反應284第五節鏈反應285一、鏈反應的基本...
一、范特霍夫規則164二、阿倫尼烏斯方程164三、活化能166四、反應的適宜溫度167第四節複合反應167一、對峙反應167二、平行反應170三、連串反應170...
一、范特霍夫規則145二、阿倫尼烏斯方程145三、活化能147四、反應的適宜溫度148第四節複合反應149一、對峙反應149二、平行反應151三、連串反應152...
