專利背景 豬是最早的家養動物,截至2010年12月已經有7000多年的歷史,是最重要的農業動物之一。豬肉不僅是人類動物蛋白的主要來源,占世界紅肉消費量的43%(Rothschild and Ruvinsky,1998),也是中國最主要的動物性食品,隨著人類生活水平的提高,動物性食品安全問題日益受到重視。現代畜牧生產的重點包括兩個方面:一、提高豬的抗病性,即抗病育種,從而降低單位產品的生產成本,減少藥物殘留,提高畜產品質量;二、運用現代育種技術,結合分子標記技術,提高豬生產性能。
在2010年過去一段時間裡,人們過於注重豬的生長速度的提高,忽視了對其抗病性能的選育,因而豬的快速生長也伴隨著抗病性的降低;相關研究表明某一特定基因型的豬其生長速度和胴體組成在一定程度上決定其健康水平。抗病性好,健康的豬採食量、生長速度和飼料轉換效率都比較高;此外,還可改變豬的胴體組成,使豬沉積更多的肌肉或體蛋白,儘量減少脂肪組織的沉積。然而,豬免疫能力與生產性能間的相互關係仍然不十分清楚,因此從分子水平上揭示出生產性能和免疫力控制基因間的相互關係是關鍵,也為家畜的分子輔助育種提供了新的思路。
個體免疫力是衡量動物健康狀況的一個重要指標,它屬於數量性狀,所涉及的相關基因較多,分子機制也較複雜。當個體受到病原體侵染時,機體會調動三方面的防禦機制,即上皮防禦機制、非特異性防禦機制和特異性防禦機制加以抵抗。豬的健康狀況取決於侵染和防禦機能相互作用的結果,若防禦技能強便表現出自然抵抗力。
抗病性主要組織相容性複合體(Major Histocompatibility complex,MHC)是與抗病性和免疫應答密切相關的一組基因群,豬的MHC(命名為SLA)位於豬的7號染色體上(Warner,Mapping of C2,Bf,and C4 genes to the swine major histocompatibility complex.Immunology.1987,139:3388-3395),包括I型和II型基因,其中I型基因具有較強的多態性,Rothschild實驗室長期從事豬SLA基因單倍型與豬初生重、生長速度、背膘厚等性狀的研究,他們認為SLA基因單倍型與上述生產性能存在相關關係(Rothschild MF,Identification of quantitative trait lociand interesting candidate genes in the pig:progress and prispects.Proc 6th WCGALP 1998,26:403-409)。Mallard等(1998)在經8代選擇形成的豬高免疫應答(H系)和低免疫應答(L系)品系中發現H系比L系早10d達到上市體重,上述研究表明豬的SLA與多種生產性狀均有連鎖,且豬的SLA與生長、背膘和繁殖性狀間的聯繫多呈正相關關係。同時對生產性狀和免疫性狀進行選擇是可行的,因而,能同時影響豬生長性狀和免疫性狀的基因就顯得尤為重要,這類基因也就成為分子輔助育種研究的重點對象。
Olfactomedin家族是一類結構上獨特的細胞外蛋白。1991年,Snyder等首次從蛙嗅覺組織中克隆得到Olfactomedin,之後,Danielson和Karavanich等分別在大鼠和小鼠中分離獲得,已有100多個OLF家族成員被相繼發現。在脊椎動物中OLF家族包含68個成員,分為I、II、III、IV、V、VI、VII七個亞系(Zeng et al.2005)。已證實,OLF蛋白在嗅腺中特異表達,並與嗅覺感受器神經元密切相關。一些OLF成員在各種生理學過程中發揮著重要作用,例如:TIGR/Myocilin與人類疾病相關,Myocilin OLF區域的回歸突變與慢性青光眼密切相關,Noelin在神經發育過程中發揮著重要作用。
等位基因與性狀間的關聯可以找出許多與該性狀具有關聯的分子標記,從而為標記輔助選擇(MAS)乃至分子育種提供理論依據。因此各國動物育種學家包括人類疾病研究者都渴望通過這種簡短而有效的方法找到“放之世界而皆準”的分子遺傳標記。分子遺傳標記可較早地對種豬進行選擇,因此合適的遺傳標記對於開展標記輔助選擇,加快遺傳進展,並最終實現分子育種是極其重要的。另外,研究突變位點在群體中的多態性,並進行性狀關聯分析是研究基因功能的一個強有力的手段。在群體中通過性狀關聯分析尋找與豬免疫性狀相關的基因,進行分子育種始終是育種工作者的一項重要而艱巨的任務。
發明內容 專利目的 《與豬免疫性狀相關的蛋白及其編碼基因和套用》的目的是提供一種與豬免疫性狀相關的蛋白及其編碼基因和套用。
技術方案 《與豬免疫性狀相關的蛋白及其編碼基因和套用》所提供的豬免疫相關蛋白,名稱為OLFML3,來源於豬,是如下(a)或(b):
(a)由序列表中序列1所示的胺基酸序列組成的蛋白質;
(b)將序列表中序列1所示的胺基酸序列經過一個或幾個胺基酸殘基的取代和/或缺失和/或添加且與豬免疫性狀相關的由序列1衍生的蛋白質。
為了使(a)中的OLFML3便於純化,可在由序列表中序列1所示的胺基酸序列組成的蛋白質的氨基末端或羧基末端連線上如表1所示的標籤。
表1 標籤的序列 上述(b)中的OLFML3可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述(b)中的OLFML3的編碼基因可通過將序列表中序列2或3所示的DNA序列中缺失一個或幾個胺基酸殘基的密碼子,和/或進行一個或幾個鹼基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標籤的編碼序列得到。
序列表的序列1所示蛋白由407個胺基酸殘基組成。
編碼所述蛋白的基因也屬於《與豬免疫性狀相關的蛋白及其編碼基因和套用》的保護範圍。
所述基因可為如下(1)或(2)或(3)或(4)或(5)所述的DNA分子:(1)序列表中序列2自5’末端第47至1270位核苷酸所示的DNA分子;(2)序列表中序列2所示的DNA分子;(3)序列表中序列3所示的DNA分子;(4)在高嚴謹條件下與(1)或(2)或(3)限定的DNA序列雜交且編碼豬免疫性狀相關蛋白的DNA分子;(5)與(1)或(2)或(3)限定的DNA序列至少具有90%以上同源性且編碼豬免疫性狀相關蛋白的DNA分子。
所述高嚴謹條件為雜交後用含0.1×SSPE(或0.1×SSC)、0.1%SDS的溶液在65攝氏度下洗膜。
序列表的序列2所示基因由1770個核苷酸組成,自5’末端第1-46位核苷酸序列為5’非翻譯區(UTR)、第47-1270位核苷酸為開放閱讀框,第1271-1770位核苷酸序列為3’UTR,第1732-1738鹼基對位核苷酸序列為ATTAAAA加尾信號,第1753-1770位核苷酸為PolyA尾巴。
序列表的序列3所示基因由2798個核苷酸組成,包含3個外顯子和2個內含子,自5’末端第47-158位核苷酸為第1外顯子,第159-862鹼基對位核苷酸為第1內含子,第863-1153位核苷酸為第2外顯子,第1154-1477鹼基對位核苷酸為第2內含子,第1478-2298鹼基對位核苷酸為第3外顯子。
含有所述基因的重組載體、表達盒、轉基因細胞系或重組菌均屬於《與豬免疫性狀相關的蛋白及其編碼基因和套用》的保護範圍。擴增所述基因的全長或其任意片段的引物對也屬於《與豬免疫性狀相關的蛋白及其編碼基因和套用》的保護範圍。
《與豬免疫性狀相關的蛋白及其編碼基因和套用》還提供一種輔助鑑別具有不同免疫性狀豬的試劑,為序列表的序列5所示DNA和序列表的序列6所示DNA組成的引物對;所述免疫性狀為白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種。所述豬具體可為五指山豬、巴馬香豬、通城豬、長白豬、大白豬、大長通[LW×(LD×T),T代表通城豬,LD代表長白豬,LW代表大白豬]和長大通[(LD×(LW×T),T代表通城豬,LD代表長白豬,LW代表大白豬)中的至少一種。
含有所述試劑的試劑盒也屬於《與豬免疫性狀相關的蛋白及其編碼基因和套用》的保護範圍,所述試劑盒還可含有限制性內切酶Hae II。
所述試劑可用於製備輔助鑑別具有不同免疫性狀豬的試劑盒;所述免疫性狀為白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種。所述豬具體可為五指山豬、巴馬香豬、通城豬、長白豬、大白豬、大長通[LW×(LD×T),T代表通城豬,LD代表長白豬,LW代表大白豬]和長大通[(LD×(LW×T),T代表通城豬,LD代表長白豬,LW代表大白豬)中的至少一種。
所述試劑可用於輔助鑑別具有不同免疫性狀的豬;所述免疫性狀為白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種。所述豬具體可為五指山豬、巴馬香豬、通城豬、長白豬、大白豬、大長通[LW×(LD×T),T代表通城豬,LD代表長白豬,LW代表大白豬]和長大通[(LD×(LW×T),T代表通城豬,LD代表長白豬,LW代表大白豬)中的至少一種。
《與豬免疫性狀相關的蛋白及其編碼基因和套用》還保護一種輔助鑑別具有不同免疫性狀豬的方法,包括如下步驟:檢測待測豬的序列表的序列2所示的OLFML3基因自5’末端第585位核苷酸是G還是T,確定待測豬的基因型是GG還是GT,GT基因型豬的白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種高於GG基因型的豬。
所述方法具體可包括如下步驟:(1)提取待測豬的基因組DNA;(2)以所述基因組DNA為模板,用序列表的序列5所示DNA和序列表的序列6所示DNA組成的引物對進行PCR擴增,得到PCR擴增產物;(3)用限制性內切酶Hae II酶切所述PCR擴增產物;如果PCR擴增產物只有一種,且不能被限制性內切酶Hae II酶切,待測豬為TT基因型;如果PCR擴增產物只有一種,且能被限制性內切酶Hae II酶切,待測豬為GG基因型;如果PCR擴增產物有兩種,其中一種能被限制性內切酶Hae II酶切,另一種不能被限制性內切酶Hae II酶切,待測豬為GT基因型。
所述PCR擴增產物為383鹼基對。所述PCR擴增產物如果可以被限制性內切酶Hae II酶切,應得到71鹼基對和312鹼基對的酶切產物。
所述待測豬具體可為五指山豬、巴馬香豬、通城豬、長白豬、大白豬、大長通[LW×(LD×T),T代表通城豬,LD代表長白豬,LW代表大白豬]和長大通[(LD×(LW×T),T代表通城豬,LD代表長白豬,LW代表大白豬)中的至少一種。
所述方法可用於豬的育種。具體可選擇GT基因型的豬進行育種。
改善效果 《與豬免疫性狀相關的蛋白及其編碼基因和套用》公開了豬免疫性狀相關的蛋白OLFML3及其編碼基因(全長cDNA和基因組DNA),並公開了基因組DNA中的一個位點的突變(G585→T585),套用該點突變,用該發明的提供的特異引物對和限制性內切酶Hae II,可通過RFLP輔助鑑別具有不同免疫性狀的豬,從而實現早期選育。該發明為豬的分子設計育種和標記輔助選擇提供了新的技術手段,將在豬的育種中發揮重要作用。
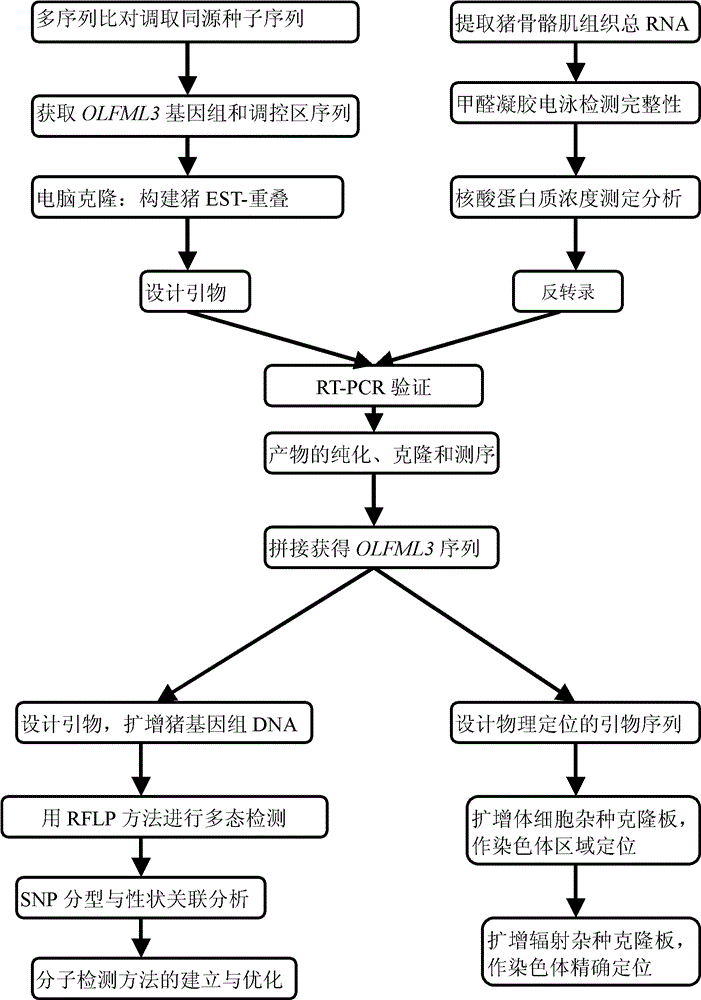
附圖說明 圖1為《與豬免疫性狀相關的蛋白及其編碼基因和套用》中OLFML3蛋白及其編碼基因、及其相關SNP的發現和套用的流程。
圖1
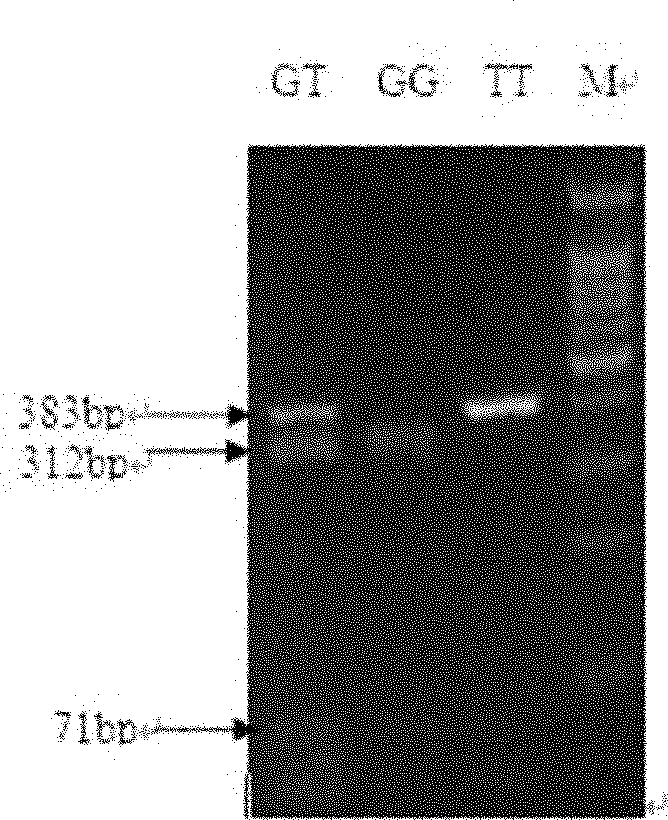
圖2為豬三種基因型(GG,GT,TT)樣本的酶切產物的電泳圖;M:DNA分子量標準(100-1500鹼基對 ladder)。
圖2
技術領域 《與豬免疫性狀相關的蛋白及其編碼基因和套用》屬於基因工程技術領域,涉及一種與豬免疫性狀相關的蛋白及其編碼基因和套用,還涉及基於所述編碼基因的單核苷酸多態及套用其鑑別具有不同免疫性狀的豬的方法。
權利要求 1.一種蛋白質,是由序列表中序列1所示的胺基酸序列組成的蛋白質。
2.編碼權利要求1所述蛋白的基因。
3.如權利要求2所述的基因,其特徵在於:所述基因是如下(1)或(2)或(3)所述的DNA分子:(1)序列表中序列2自5’末端第47至1270位核苷酸所示的DNA分子;(2)序列表中序列2所示的DNA分子;(3)序列表中序列3所示的DNA分子。
4.含有權利要求2或3所述基因的重組載體。
5.含有權利要求2或3所述基因的表達盒。
6.含有權利要求2或3所述基因的轉基因細胞系。
7.含有權利要求2或3所述基因的重組菌。
8.擴增權利要求2或3所述基因的全長的引物對;所述引物對為序列表的序列5所示DNA和序列表的序列6所示DNA組成的引物對。
9.輔助鑑別具有不同免疫性狀豬的試劑,為序列表的序列5所示DNA和序列表的序列6所示DNA組成的引物對;所述免疫性狀為白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種。
10.權利要求9所述試劑在製備輔助鑑別具有不同免疫性狀豬的試劑盒中的套用;所述免疫性狀為白細胞數、血紅蛋白濃度和血細胞平均血紅蛋白含量中的至少一種。
實施方式 一、豬OLFML3蛋白及其cDNA序列和基因組DNA序列的獲得
(一)cDNA序列的獲得
1、以人的同源基因的cDNA(GenBank收錄號:NM_020190.2)為信息探針,利用NCBI中的BLAST工具在GenBank豬EST資料庫中做同源序列篩選,獲得一系列同源性為85%以上的ESTs(片段長度大於100鹼基對),將這些ESTs的收錄號在NCBI中用ENTREZ查詢相應序列,然後用軟體DNAStar中的Seqman程式構建豬的EST重疊群,從而獲得拼接的豬cDNA序列。
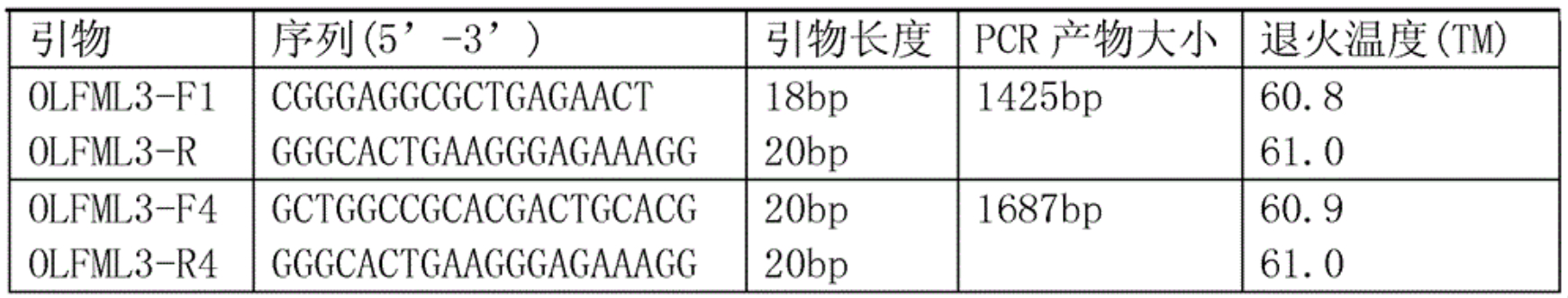
2、根據拼接的豬cDNA序列設計四對引物(見表2)。
表2 用於豬OLFML3基因分離的引物信息
3、反轉錄PCR擴增反應
提取長白豬的總RNA。
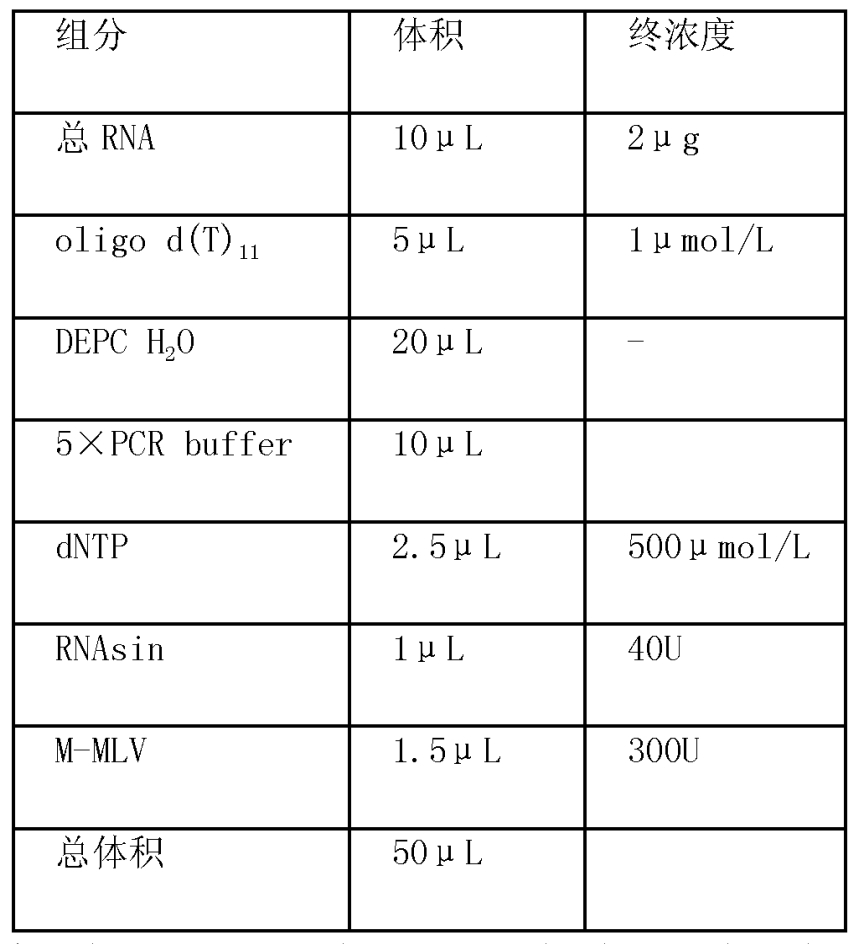
cDNA第一鏈的的合成:反應體系(見表3)為50微升,首先將2微克總RNA與oligod(T)11混合於Ependorff管中,70攝氏度溫育5分鐘以解除RNA的二級結構,立即置於冰上冷卻以避免二級結構的重新生成,經短暫離心後按照表3加入其餘組分,於37攝氏度溫育1小時後將溫度升至95攝氏度滅活反轉錄酶,置於-20攝氏度保存備用。
表3 反轉錄反應體系
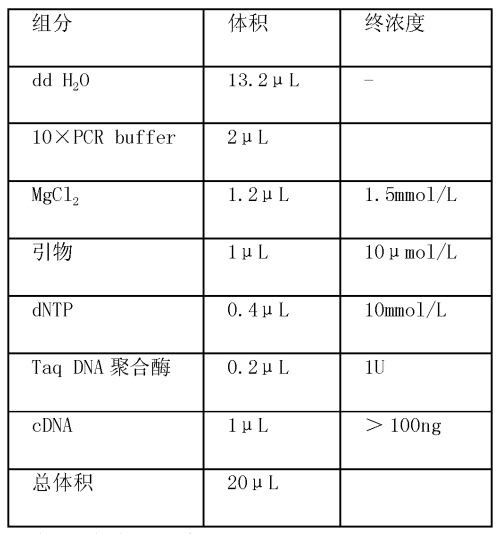
PCR反應體系總體積為20微升,各組分的加樣體積及終濃度見表4。PCR擴增程式:94攝氏度3分鐘;94攝氏度30秒,退火(退火溫度見表2)45秒,72攝氏度1分鐘,循環35次;最後72攝氏度延伸5分鐘。PCR反應產物用1.5%瓊脂糖凝膠電泳檢測。
表4 PCR反應體系
4、PCR產物的純化、克隆和測序
(1)凝膠純化
在紫外燈下從低熔點瓊脂糖凝膠上切下含目的片段的凝膠,放入1.5毫升Ependorff管中,於70攝氏度溫育至凝膠完全融化,然後用瓊脂糖凝膠回收試劑盒(天根生化科技有限公司)純化PCR產物。
(2)連線反應
將純化PCR產物與pGEM-T(Promega)載體連線,連線反應總體積是5微升,其中包括2.5微升2×buffer,0.5微升T載體,1.5微升純化PCR產物,0.5微升T4 連線酶,最後置4攝氏度水浴過夜。
(3)感受態細胞的製備
從37攝氏度培養了16-20小時的新鮮平板上挑取一個DH5α單菌落接種於2毫升LB中,於37攝氏度振盪培養3小時,轉接1毫升菌液於含有30毫升LB的鹽水瓶中,繼續在37攝氏度振盪培養約4小時,待0D600 達到0.3-0.4時將鹽水瓶從搖床取出置冰浴冷卻10-15分鐘,然後將菌液轉入離心管中於4攝氏度4000克離心10分鐘以收集細胞,將離心管倒置以棄淨培養液,用10毫升冰預冷的0.1摩爾/升的CaCl2 重懸沉澱,冰浴30分鐘,重複4攝氏度4000克離心10分鐘一次,用4毫升冰預冷的0.1摩爾/升的CaCl2 重懸沉澱,置4攝氏度保存備用。
(4)轉化
無菌狀態下取100-120微升感受態細胞於1.5毫升Ependorff管中,將5微升的連線產物加入混勻,在冰上放置30分鐘,42攝氏度熱激90秒,其間不要搖動Ependorff管,取出後冰浴3-4分鐘,加入400微升無抗生素的LB液體培養基,37攝氏度振盪培養45分鐘。取100微升塗布於已提前4小時塗布了IPTG(Isopropylthio-β-D-galactoside,異丙基硫代-β-D-半乳糖苷)和X-gal的瓊脂平板上,37攝氏度平放1小時後倒置培養。
(5)質粒的小量製備
挑取平板上的單菌落,接種於2-3毫升LB中,37攝氏度300轉/分鐘培養過夜。用1.5毫升EP管12000轉/分鐘離心數秒收集菌體。然後使用天根生化科技有限公司的質粒小提試劑盒進行質粒DNA的提取。
(6)重組質粒的酶切鑑定
取3微升質粒DNA與適量的雙蒸水混勻,使其總體積為15微升,加入2-3U限制性內切酶及2微升相應的10×限制性內切酶反應緩衝液,輕彈管壁混勻並離心,置37攝氏度水浴1-2小時,取2-3微升反應液於瓊脂糖凝膠電泳檢測,酶切結果與預計完全相同者,即為目的重組質粒。重組質粒採用雙脫氧末端終止法在DNA自動測序儀上進行測序,序列測定由英俊生物技術有限公司完成。
(7)DNA序列同源性檢索鑑定
通過美國國家生物技術信息中心(NCBI,National Center for Biotechnology Information)網站的BLAST(Basic Local Alignment Search Tool)軟體,將測序後獲得的DNA序列與GenBank資料庫中公布的已知生理功能基因進行序列同源性比較,以鑑定和獲得該DNA序列的功能信息。
(二)基因組DNA序列的獲得
1、引物設計
與豬OLFML3基因同源的人OLFML3基因組DNA(GenBank收錄號:NM_020190.2)長約2846鹼基對,有3個外顯子,2個內含子,其中第一內含子701鹼基對,第二內含子331鹼基對。將豬OLFML3基因的cDNA全長序列與其進行比對,發現豬的也具有3個外顯子,根據序列表中序列2所示的的cDNA序列設計4對引物(見表5),擴增豬的全基因組序列。
表5 OLFML3基因組DNA分離用引物
2、PCR擴增
以豬的基因組DNA為模板,並根據人的該同源基因的第一內含子長度(701鹼基對)設計反應程式,進行PCR擴增。PCR反應體系:2.0微升10×Buffer,1.6微升MgCl2 (2.5毫摩爾/升),1微升Former primer(10微摩爾/升),1微升Reverse primer(10微摩爾/升),0.4微升dNTPs(10毫摩爾/升),0.2微升Taqase,1微升DNA模板,ddH2 0定容至20微升。PCR擴增程式:95攝氏度3分鐘,30個循環(94攝氏度30秒,對應引物的溫度退火30秒,72攝氏度延伸40秒),最後在72攝氏度延伸3分鐘。擴增產物經1.5%瓊脂糖凝膠電泳鑑定。
以豬的基因組DNA為模板,並根據人的該同源基因的第二內含子長度(331鹼基對)設計反應程式,進行PCR擴增:反應體系:2.0微升10×Buffer,1.6微升MgCl2 (2.5毫摩爾/升),1微升Former primer(10微摩爾/升),1微升Reverse primer(10微摩爾/升),0.4微升dNTPs(10毫摩爾/升),0.2微升Taqase,1微升DNA模板,ddH2 O定容至20微升。PCR擴增程式:95攝氏度3分鐘,30個循環(94攝氏度30秒,對應引物的溫度退火30秒,72攝氏度延伸30秒),最後在72攝氏度延伸3分鐘。擴增產物經1.5%瓊脂糖凝膠電泳鑑定。
3、獲取序列
所得序列進行拼接,最後得到一個長約2798鹼基對的DNA片段(見序列表的序列3),其中第一內含子長704鹼基對,第二內含子長361鹼基對。
將序列表的序列1所示蛋白質命名為豬0LFML3蛋白。將豬0LFML3蛋白的編碼基因命名為豬OLFML3基因,其cDNA如序列表的序列2所示,其基因組DNA如序列表的序列3所示。
序列表的序列2所示基因由1770個核苷酸組成,自5’末端第1-46位核苷酸序列為5’非翻譯區(UTR)、第47-1270位核苷酸為開放閱讀框,第1271-1770位核苷酸序列為3’UTR,第1732-1738鹼基對位核苷酸序列為ATTAAAA加尾信號,第1753-1770位核苷酸為PolyA尾巴。
序列表的序列3所示基因由2798個核苷酸組成,包含3個外顯子和2個內含子,自5’末端第47-158位核苷酸為第1外顯子,第159-862鹼基對位核苷酸為第1內含子,第863-1153位核苷酸為第2外顯子,第1154-1477鹼基對位核苷酸為第2內含子,第1478-2298鹼基對位核苷酸為第3外顯子。
二、豬OLFML3基因物理定位
1、用於豬OLFML3基因物理定位的引物序列如下:
FMF:5′-AGAGAGAAAGCCCGCAGCA-3′;
FMR:5′-GCCGCAGTACAAACCGAGTC-3′。
靶序列長度為256鹼基對,是序列表的序列2自5′末端第1469-1724位核苷酸。
2、用於物理定位的實驗材料
用豬×嚙齒類體細胞雜種板(Pig×rodent somatic cell hybrid panel,SCHP)進行染色體區域定位(包括27個體細胞雜種細胞系,1-19號是豬×倉鼠體細胞雜種細胞系,20-27號是豬×小鼠體細胞雜種細胞系),用美國Minnesota大學共同構建的豬輻射雜種板(INRA-Minnesota porcine radiation hybrid panel,IMpRH)進行染色體精確定位(包括118個豬×倉鼠輻射雜種細胞系,以及倉鼠和豬基因組DNA陽性對照),兩套體細胞雜種板的製備方法見參考文獻(Yerle et al.,A somatic cell hybrid panel for pig regional gene mapping characterized by molecular cytogenetics.Cytogenet Cell Genet.1996,73:194-202;Yerle et al.,Construction of a whole-genome radiation hybrid panel for high-resolution gene mapping in pigs.Cytogenet Cell Genet.1998,82:182-188)。
IMpRH使用的輻射劑量是7000-rad。IMpRH包括118個豬×倉鼠輻射雜種細胞系,以及倉鼠和豬基因組DNA陽性對照,用757個標記的鑑定結果表明IMpRH中的平均標記存留率為29.3%,包含有128個連鎖群,覆蓋了18對常染色體及X染色體,用於估計標記間距離的kb/cR比值是~70kb/cR(1Ray=100cR),理論解析度是145千鹼基對。
3、PCR分型條件
在IMpRH中進行擴增的PCR反應總體積為10微升,其中模板DNA為25納克,含1×buffer(Promega),dNTP終濃度為75微摩爾/升,引物終濃度為0.3微摩爾/升,0.3UTaqDNA聚合酶(Takara)。PCR擴增程式是:94攝氏度5分鐘,循環35次:94攝氏度30秒,60攝氏度退火30秒;然後72攝氏度25秒,最後72攝氏度延伸5分鐘。PCR反應產物均用2%瓊脂糖凝膠電泳檢測。
4、豬OLFML3基因的定位效果
分型結果:00001100010100010?1100000000000000001001010010000000100010000100001000000000101010000000000100000000101000010000000010(其中0和1分別表述擴增結果為陰性和陽性)。
將以上分型數據輸入IMpRH數據統計分析伺服器,用HMAP 3.0軟體進行數據統計分析。統計分析結果,兩點分析結果顯示,OLFML3基因與豬染色體SSC14號上的已有的標記IGLV緊密連鎖,LOD值為5.26,RH圖距是0.68Ray。
一、SNP(585G/T)的發現和特異引物對的設計
在豬OLFML3基因的基因組DNA(序列表的序列3所示)中,發現一個SNP(585),根據該SNP設計一對引物(特異引物對)如下:
上游引物:5′-AGTCTGTAGCAGCCTATTCC-3′(序列表的序列5);
下游引物:5′-GACTACTCTGGTCTTGGCACT-3′(序列表的序列6)。
靶序列如序列表的序列4所示(383鹼基對),序列4即序列表的序列3自5’末端第516至898位核苷酸(位於基因組DNA第二外顯子和第二內含子中)。序列表的序列4自5’末端第70位核苷酸(序列表的序列3自5’末端第585位核苷酸)存在G→T的突變,當該核苷酸為G時,存在1個Hae II酶切位點(RGCGC^Y)。
二、套用特異引物對對各個群體進行分型
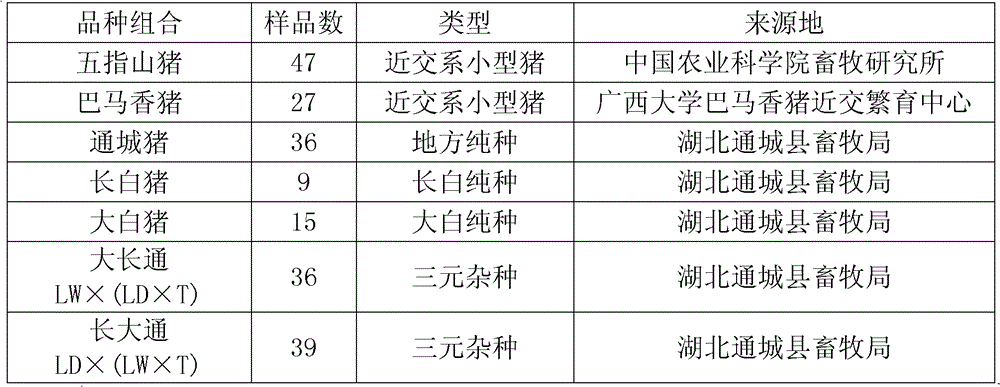
分別對7個群體的豬(見表6)進行分型。
表6 SNPs檢測的群體和樣品數
T代表通城豬,LD代表長白豬,LW代表大白豬。
1、提取待測豬的基因組DNA。
2、以基因組DNA為模板,用步驟一設計的特異引物對進行PCR擴增,得到PCR擴增產物。
PCR反應體系(20微升):基因組DNA 50納克,1×buffer,dNTP 75微摩爾/升,上、下游引物各0.3微摩爾/升,Mg1.5毫摩爾/升,Taq DNA聚合酶1.0U。
PCR擴增程式:95攝氏度預變性5分鐘;94攝氏度變性30秒,61攝氏度退火30秒,72攝氏度延伸30秒,共35個循環;72攝氏度延伸5分鐘。
3、將PCR擴增產物用限制性內切酶Hae II酶切,得到酶切產物。
酶切反應體系(10微升):其中1微升10×buffer,3-5微升PCR擴增產物,0.5微升(5.0U)限制性內切酶Hae II,用ddH2 O補足10微升。
酶切反應體系混勻後離心,37攝氏度溫育4小時。
4、將酶切產物進行2%瓊脂糖凝膠電泳,凝膠成像系統照像,記錄基因型並統計基因頻率。
所有酶切產物顯示三種帶型,基於酶切產物的電泳圖分型如下:
帶型I:顯示71鹼基對和312鹼基對的兩條帶(因71鹼基對條帶較小,比較微弱,電泳圖上沒有清晰顯示);
帶型II:顯示383鹼基對的一條帶;
帶型III:顯示383鹼基對、312鹼基對和71鹼基對的三條帶。
5、將步驟2的各個PCR擴增產物分別進行測序,測序結果與帶型顯示的結果一致,基於測序結果分型如下:
GG型:PCR擴增產物(383鹼基對)如序列表的序列4所示,該PCR擴增產物能被限制性內切酶Hae II酶切,產生71鹼基對和312鹼基對的兩個酶切產物;該PCR擴增產物的酶切產物電泳顯示帶型I(因71鹼基對條帶較小,比較微弱,電泳圖上沒有清晰顯示)。
TT型:PCR擴增產物(383鹼基對)為將序列表的序列4自5’末端第70位核苷酸突變為T得到的DNA片段,該PCR擴增產物不能被限制性內切酶Hae II酶切;該PCR擴增產物的酶切產物電泳顯示帶型II。
GT型:PCR擴增產物為GG型的PCR產物和TT型的PCR產物的混合物;該PCR擴增產物的酶切產物電泳顯示帶型III(即GG型的酶切產物和TT型的酶切產物的疊加)。
部分基因型的樣本的酶切產物的2%的瓊脂糖凝膠電泳圖見圖2。
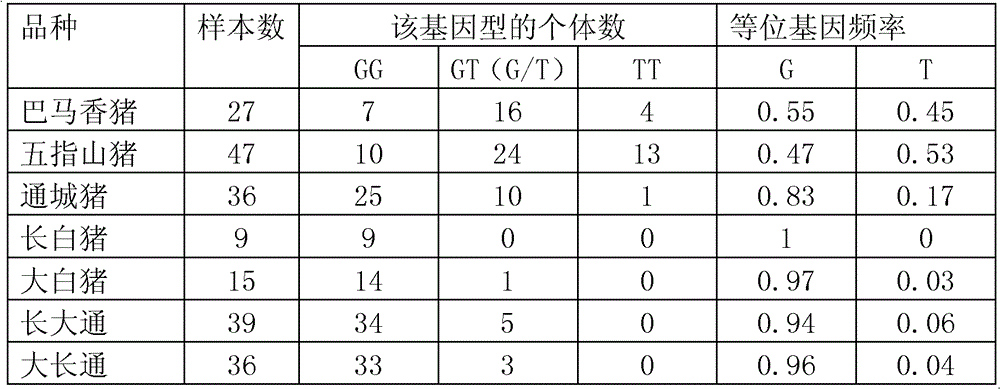
7個群體的基因型及等位基因頻率統計結果如表7所示,為OLFML3 SNP(585)多態性在7個豬群中的分布。
表7
如表7所示,可以明顯看出該SNP位點在兩種小型豬(巴馬小型豬、五指山小型豬)中G和T基因型的分布較為均勻。而在其它幾個豬品種中以偏G型存在。
三、性狀關聯分析
根據SNP的分型統計結果,對大白豬,長白豬,通城豬,大長通豬和長大通豬5個豬群組成的整個群體(總計134頭;其中大白豬、長白豬、大長通豬和長大通豬均為表7中的樣本,通城豬為表7中GG基因型和GT基因型的樣本)進行性狀關聯分析。
1、分別檢測134隻豬的白細胞數(WBC)、血紅蛋白濃度(HGB)和血細胞平均血紅蛋白含量(MCHC)。
2、數據處理:套用SAS8.0軟體中的廣義線性模型(General Linear Model)程式進行性狀關聯分析。
首先建立分析模型甲以消除性別、組合及批次對表型值的影響:Yijk=μ+BATCHi+SEXj+COMBINATIONk+(BS)ij+(BC)ik+(SC)jk+εijkl,其中,Yijk是性狀觀察值,μ為總體均數,BATCHi為批次效應,SEXj為性別效應,COMBINATIONk為組合的效應,(BS)ij為批次和性別的互作效應,(BC)ik為批次和組合的互作效應,(SC)jk為性別和組合的互作效應,εijk為隨機誤差,假定服從N(0,σ2)分布。
套用分析模型甲對於每個原始性狀都獲得了一個新的性狀值,即標準化的殘差值,然後將所獲得殘差值作為新的性狀值,再建立如下的分析模型乙:Yij=μ+GENOTYPEi+εij,Yij是新的性狀值,μ新的性狀值的總體均值,GENOTYPEi為基因型效應,εij為隨機誤差,假定服從N(0,σ2)分布。
套用分析模型乙根據最小二乘分析法分析基因型的效應,同時進行基因型間的兩兩比較。
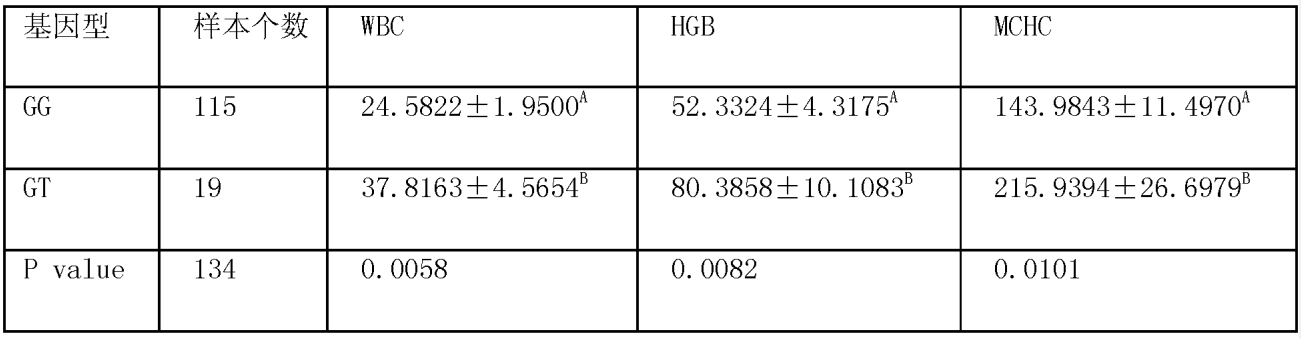
結果發現,585突變位點與豬的免疫性狀顯著相關,115個個體為GG基因型,19個個體為GT基因型,GG基因型與GT基因型的豬免疫性狀差異顯著。基因型間性狀的平均數和標準差分析結果總結於表8。
表8 不同基因型(585G/T)群體的免疫性狀比較
不同的肩標表示統計學上差異顯著。
應選擇WBC、HGB和MCHC值較高的GT型豬進行育種。
專利榮譽 2021年6月24日,《與豬免疫性狀相關的蛋白及其編碼基因和套用》獲得第二十二屆中國專利優秀獎。