專利背景
腦組織含有豐富的
蛋白質,長期以來人們一直研究把動物腦組織的蛋白質水解成胺基酸和低分子多肽,用來治療腦血管代償不足所致的功能失調、中風、腦記憶障礙和腦外傷引起的功能紊亂、腦振盪後遺症等疾病。
腦蛋白水解物在中國國內又稱腦活素,早於20世紀90年代初,中國國內學者便對其工藝、質量、藥理藥效及臨床套用進行了研究,發表了大量的文章。
中國發明專利文獻CN01130523.1公開了一種“腦蛋白水解物注射液生產工藝”,其內容是:新鮮豬腦去除表面的黏膜及血漬等,加2倍體積的水勻漿,用雙層紗布過濾,濾液先用胃蛋白酶水解,用鹽酸調pH到1.5~1.6,水浴溫度40~45℃,時間為6~8小時,再用氫氧化鈉調pH到7.6~7.7,加胰酶(胰酶先溶解於0.02N的氯化鈣溶液中於4℃下活化30分鐘)水解,40~45℃水浴水解4~6小時,得到水解液,加鹽酸調pH值2.5~3.0,-20~10℃下靜置10~30小時;在室溫條件下,用雙層紗布過濾,再加入1/2體積的水,加
氫氧化鈉調pH值到中性,用孔徑為0.5~1.0微米的微孔濾膜過濾澄清,取澄清液,依次用截流分子量為7萬和1萬的超濾膜超濾,得到的超濾液再用截流分子量為1000的超濾膜進行濃縮,得到的濃縮液加熱到100℃沸騰15分鐘,然後迅速冷卻到25℃以下,再依次經過0.5~1微米孔徑的微孔濾膜和截流分子量為7萬和1萬的超濾膜,得到的超濾液再經121℃蒸汽滅菌30分鐘得到的除菌溶液稱為腦蛋折水解的混合多肽、胺基酸溶液精製品;根據所需藥液量,按國家藥品監督管理局2000年12月28日頒布的藥品標準(編號WS1-XG-25-2000)計算需要添加的胺基酸用量,與上述溶液配製成濃配液,然後稀配裝針成成品藥液,經121℃蒸汽滅菌30分鐘成無菌製劑。其缺點是:(1)料液多次經過0.5~1微米孔徑的微孔濾膜和截流分子量為7萬和1萬的超濾膜,得到的超濾液,使操作比較煩瑣,生產周期長,生產過程中容易受微生物污染。(2)使用超濾膜進行超濾濃縮回收率低:該工藝採用截流分子量為1000的超濾膜進行濃縮,因腦蛋白水解物的有效活性成分為小分子多肽,在超濾濃縮過程中會有不同程度的透過丟失,收率大大降低。
2000年,余李碧等在《胺基酸和生物資源》發表了“腦蛋白粉的製備及其酶解方法的研究”,其內容為:取鮮豬腦去膜、去血塊洗淨,按1:5(w/v)加入生理鹽水勻漿,再按1:10(w/v)加入冰凍丙酮攪拌提取2小時,靜置分層後紗布過濾,共提取4次。濾塊用乙醚按1:10(w/v)提取2次,過濾,濾塊乾燥,腦粉按1:20(w/v)加蒸餾水溶解,煮沸30分鐘,於47±0.5℃平衡,用NaOH調pH8.0,加胰酶水解30小時,用HCl調pH6.0,煮沸40分鐘,稍冷,過濾,濾液煮沸、冷卻、4℃存放過夜。
布氏漏斗抽濾,收集濾液,浴溫58~69℃減壓濃縮至原體積的1/3,煮沸、冷卻、4℃存放24小時。抽濾得濾液,補加無熱源水至原體積、6%白陶土和0.6%活性炭,調pH4.4~4.6,煮沸1小時,趁熱抽濾得濾液。調pH7.0,煮沸,冷卻、4℃存放24小時以上。後用G
6無菌過濾,收集濾出液,立即超濾,收集截留分子量1萬以下液體,無菌分裝、熱原試驗、質檢。其缺點是:(1)生產周期長,設備投資大,生產效率低;在pH8.0、47±0.5℃條件下胰酶水解30小時,生產周期長,容易受微生物污染,難於保證藥品質量;只用胰酶水解,水解並不完全,而且固液難於分離,生產過程中損耗大;使用減壓濃縮步驟,生產效率低,不利於對藥品質量的控制。(2)、使用大量的有機化學溶劑,
丙酮和
乙醚的沸點極低,是易燃、易爆、有毒的危險化學品,乙醚還被用作麻醉劑,使用大量的丙酮和乙醚先將腦蛋白沉澱出來製成腦蛋白粉,此步驟非常危險,必須在防爆車間內生產,操作煩瑣,污染環境,危害生產操作人員的身體健康。
發明內容
專利目的
《腦蛋白水解物及其凍乾製劑的生產方法》的目的在於提供一種新型的腦蛋白水解物生產方法,這種方法同2006年3月前已有的生產方法相比,具有生產環節收少、收率高、生產成本低且安全無污染。
技術方案
一種腦蛋白水解物的生產方法,該方法包括如下步驟:
(1)取經檢驗合格的新鮮或凍存健康豬腦,用膠體磨勻漿,收集勻漿液;
(2)將勻漿液分別用胃蛋白酶、胰酶水解,收集水解上清液,進行過濾,收集濾出液;
(3)將濾出液用羥基磷灰石層析柱進行吸附分離純化,調配肽圖,收集目標物;
(4)採用對分子截留為8千道爾頓的濾膜進行超濾,收集濾出液,進行定氮、胺基酸分析;
(5)按國家藥品監督管理局2000年12月28日頒布的編號為WS1-XG-25-2000藥品標準計算胺基酸用量,添加相應胺基酸配製成濃配液,0.22微米濾膜進行精過濾,即得注射用腦蛋白水解物的原液。
該發明還提供了一種腦蛋白水解物凍乾製劑的生產方法,該方法為:
(1)取經檢驗合格的新鮮或凍存健康豬腦,用膠體磨勻漿,收集勻漿液;
(2)將勻漿液分別用胃蛋白酶、胰酶水解,收集水解上清液,進行過濾,收集濾出液;
(3)將濾出液用羥基磷灰石層析柱進行吸附分離純化,調配肽圖,收集目標物;
(4)採用對分子截留為8千道爾頓的濾膜進行超濾,收集濾出液,進行定氮、胺基酸分析;
(5)按國家藥品監督管理局2000年12月28日頒布的編號為WS1-XG-25-2000藥品標準計算胺基酸用量,添加相應胺基酸配製成濃配液,0.22微米濾膜進行精過濾,得注射用腦蛋白水解物的原液;
(6)將注射用腦蛋白水解物原液與賦形劑及溶劑混均,用活性碳脫色經粗濾和精濾,分裝入西林瓶中;
(7)經過凍乾處理,得凍乾製劑。
改善效果
1、不使用丙酮、乙醚等化學危險品製備腦蛋白粉,新鮮或凍存豬腦直接經雙酶酶解等生產工藝提取腦蛋白水解物,具安全無污染、少投入生產設備、減少生產環節等優點。
2、雙酶水解腦組織勻漿液,採用抽取、殘渣離心獲得上清液,經過濾、上羥基磷灰石層析柱吸附分離純化,超濾等生產工藝,水解完全,可除去雜蛋白和大分子雜質,使HPLC雜質峰面積小於5%,達到2006年3月前已有工藝的分離效果。
3、採用雙酶酶解,抽取、殘渣離心獲得上清液,經過濾、上羥基磷灰石層析柱吸附分離純化,超濾等生產工藝,優點是生產步驟、周期大大縮短、收率提高、生產成本降低、生產環境要求降低、操作簡便,減少了藥品受微生物污染、變質的機會。該工藝穩定可靠,符合GMP要求。
附圖說明
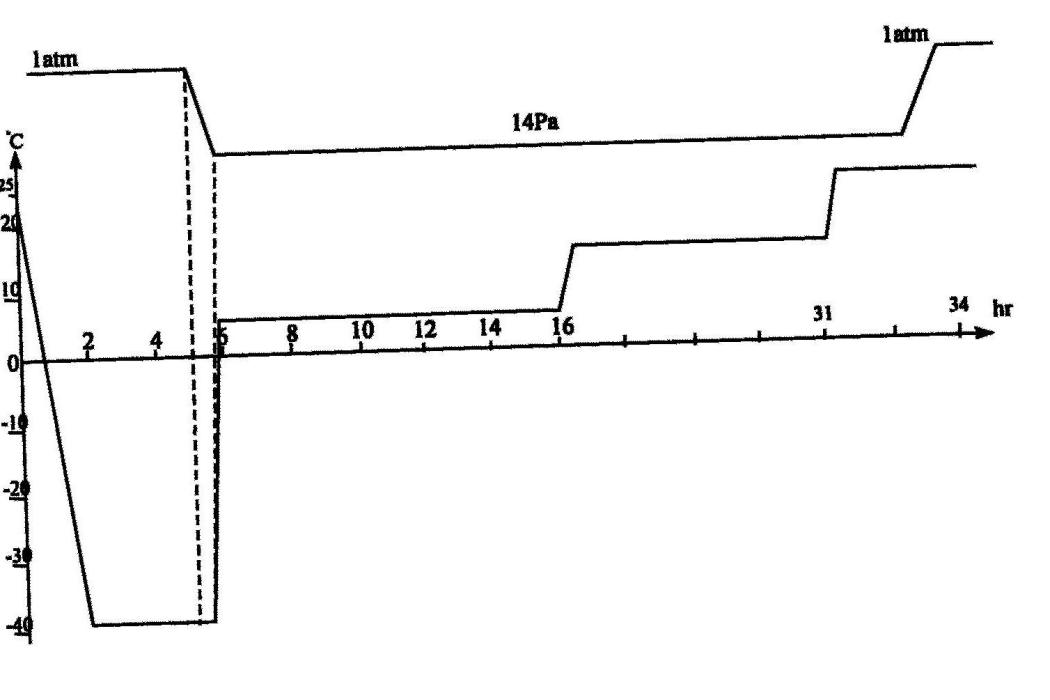
圖1為注射用腦蛋白水解物凍乾曲線。
圖2為腦蛋白水解物注射液鑑別圖譜。
圖3為注射用腦蛋白水解物鑑別圖譜。
權利要求
1、一種腦蛋白水解物的生產方法,該方法包括如下步驟:
(1)取經檢驗合格的新鮮或凍存健康豬腦,用膠體磨勻漿,收集勻漿液;
(2)將勻漿液分別用胃蛋白酶、胰酶水解,收集水解上清液,進行過濾,收集濾出液;
(3)將濾出液用羥基磷灰石層析柱進行吸附分離純化:羥基磷灰石層析柱裝柱後先用400毫摩爾/升pH6.8磷酸鹽緩衝液清洗,再用20毫摩爾/升pH6.8磷酸鹽緩衝液平衡,將上述濾出液上羥基磷灰石層析柱進行吸附,用20毫摩爾/升pH6.8磷酸鹽緩衝液洗脫;
(4)收集目標物,採用對分子截留為8千道爾頓的濾膜進行超濾,收集濾出液,進行定氮、胺基酸分析檢驗;
(5)按國家藥品監督管理局2000年12月28日頒布的編號為WS1-XG-25-2000藥品標準計算胺基酸用量,添加相應胺基酸配製成濃配液,0.22微米濾膜進行精過濾,即得注射用腦蛋白水解物的原液。
2、一種腦蛋白水解物凍乾製劑的生產方法,該方法為:
(1)取經檢驗合格的新鮮或凍存健康豬腦,用膠體磨勻漿,收集勻漿液;
(2)將勻漿液分別用胃蛋白酶、胰酶水解,收集水解上清液,進行過濾,收集濾出液;
(3)將濾出液用羥基磷灰石層析柱進行吸附分離純化:羥基磷灰石層析柱裝柱後先用400毫摩爾/升pH6.8磷酸鹽緩衝液清洗,再用20毫摩爾/升pH6.8磷酸鹽緩衝液平衡,將上述濾出液上羥基磷灰石層析柱進行吸附,用20毫摩爾/升pH6.8磷酸鹽緩衝液洗脫;
(4)收集目標物,採用對分子截留為8千道爾頓的濾膜進行超濾,收集濾出液,進行定氮、胺基酸分析檢驗;
(5)按國家藥品監督管理局2000年12月28日頒布的編號為WS1-XG-25-2000藥品標準計算胺基酸用量,添加相應胺基酸配製成濃配液,0.22微米濾膜進行精過濾,得注射用腦蛋白水解物的原液;
(6)將注射用腦蛋白水解物原液與賦形劑及溶劑混均,用活性碳脫色經粗濾和精濾,分裝入西林瓶中;
(7)經過凍乾處理,得凍乾製劑。
3、如權利要求4所述的腦蛋白水解物凍乾製劑的生產方法,其特徵在於:所述的賦形劑為甘露醇,溶劑為注射用水,以總氮30克的注射用腦蛋白水解物原液加240克甘露醇,再加注射用水至4000毫升。
4、如權利要求4或5所述的腦蛋白水解物凍乾製劑的生產方法,其特徵在於:所述的凍乾處理過程為先降溫至-38℃,維持3小時,然後抽真空,達到14帕後,開始升溫至5℃,維持10小時;再維持真空度14帕,升溫至15℃,維持15小時;進一步維持真空度14帕,升溫至25℃,維持3小時;壓塞,恢復大氣壓,出箱。
實施方式
實施例1、注射用腦蛋白水解物(原液)的生產
取經檢驗合格的新鮮或凍存健康豬腦100.0千克,去除結締組織及碎骨等非腦組織物,用注射用水洗淨,瀝乾,先用絞肉機絞成碎塊,用調節刻度至200目的膠體磨磨細,收集勻漿液,加入150.0千克(1.5倍重)的注射用水攪勻。將漿液加溫至42℃±2℃,用4.5%鹽酸調pH至1.5~1.7,按每千克漿液加入10克胃蛋白酶的比例(1%),加入2.5千克胃蛋白酶,維持pH1.5~1.7、42℃±2℃的條件水解8小時。用5摩爾/升NaOH將胃蛋白酶水解漿液調pH至7.1~7.3,按每千克漿液加入10克胰酶的比例(1%),加入2.5千克胰酶,攪勻後,維持在pH7.5~7.7、42℃±2℃水解4小時,酶解結束後加熱升溫至100℃,保溫15分鐘後,降溫至30℃以下。用4.5%鹽酸調pH2.8~3.0,靜置過夜。抽濾得上清液176.0千克,殘渣用離心機離心,收集上清液的53.0千克,合併上清液,共229.0千克,進行粗過濾,收集濾出液得227.0千克,用5摩爾/升NaOH調pH至6.8~7.0,備用。用注射用水將羥基磷灰石調成糊狀,採用淤漿式法裝柱,裝柱壓力0.5兆帕。裝柱後先用400毫摩爾/升pH6.8磷酸鹽緩衝液清洗,再用20毫摩爾/升pH6.8磷酸鹽緩衝液平衡,將上述濾出液上羥基磷灰石層析柱進行吸附,用20毫摩爾/升pH6.8磷酸鹽緩衝液洗脫。收集目標物得285.0千克,用對分子截留為8K的濾膜進行超濾,收集濾出液得274.0千克,進行肽圖、胺基酸檢驗。按國家藥品監督管理局2000年12月28日頒布的藥品標準(編號WS1-XG-25-2000)計算胺基酸用量,添加相應胺基酸配製成濃配液,0.22微米濾膜進行精過濾,即得注射用腦蛋白水解物的原液292.0千克。該原液可按凍乾製劑處方製備成品。
在100千克投料量情況下,得到的腦蛋白水解物原液總氮量為5069.12克,高於2006年3月前已有技術2636.48克,表明收率約提高了約93%。
實施例2、注射用腦蛋白水解物凍乾劑的生產方法
(1)原輔料的準備
在10000級潔淨區內,將全檢合格的腦蛋白水解物原液和甘露醇按處方量加入配液罐中,加入注射用水至刻度,充分攪拌混勻,按液體量0.2%加入活性碳,攪拌脫色20分鐘,0.45微米膜粗濾,再經0.22微米膜精濾,測其含量,送入100級分裝間,待用。
處方為:腦蛋白水解物原液約相當於總氮30.0克、甘露醇240克、注射用水加至4000.0毫升、分裝成1000瓶;處方中,腦蛋白水解物原液為主藥,甘露醇為賦型劑,注射用水為溶劑。
(2)包裝材料的準備
①西林瓶的準備:7毫升西林瓶經超音波清洗後,接著分別用去離子水、注射用水洗滌,再用潔淨壓縮空氣吹乾,最後在0.5小時內通過溫度達280-300℃的隧道烘箱滅菌和去除熱原,待用。
②丁基膠塞的準備:丁基膠塞先分別用去離子水洗淨,接著用注射用水反覆漂洗,然後在121℃條件下濕熱滅菌20分鐘,之後,真空抽盡水蒸氣,冷涼,待用。
③鋁蓋的準備:鋁蓋經純化水清洗後,在120℃條件下乾熱150分鐘,待用。
(3)分裝,半壓塞
分裝調試機器正常後,將經洗淨烘乾滅菌冷涼的空瓶送入分裝間,根據含量確定分裝體積,按注射劑分裝規程進行分裝,半壓塞。
(4)凍乾:將分裝好樣品的7毫升西林瓶送入凍乾箱中,按圖1所示的注射用腦蛋白水解物特定的凍乾曲線進行凍乾操作,凍乾結束後,將膠塞完全壓入西林瓶中。
凍乾過程為:1、分裝後,降溫至-38℃,維持3小時;2、抽真空,達到14帕後,開始升溫至5℃,維持10小時;3、維持真空度14帕,升溫至15℃,維持15小時;4、維持真空度14帕,升溫至25℃,維持3小時;5、壓塞,恢復大氣壓,出箱。6、凍乾全過程約需34小時。
(5)軋蓋:將凍幹完畢的半成品進行軋蓋,同時取樣全檢。
(6)目檢:軋蓋的同時,進行目檢,剔除外觀不合格品。
(7)貼簽:將目檢合格的半成品按貼簽操作規程貼上瓶簽。
(8)外包裝:貼簽結束,產品全檢合格後,裝小盒,中盒、大箱,然後入庫。
(9)鑑別圖譜:採用儀器型號為SPD-10AvpLC-10Atvp,檢測器類型為紫外,檢測波長為280納米,柱型號為TSK-GELG2000SWxl,柱溫為30℃,進樣量為10微升,流量為0.5毫升/分鐘。標準品腦蛋白水解物注射液(施普善)的鑑別圖譜分析圖譜見圖1,分析結果見表1。
注射用腦蛋白水解物凍乾製劑的鑑別圖譜如圖2所示,分析結果見表2。
通過圖1與圖2對比及表1與表2對比可知,注射用腦蛋白水解物凍乾製劑與與標準樣品的色譜圖基本一致,符合標準。
榮譽表彰
2014年11月6日,《腦蛋白水解物及其凍乾製劑的生產方法》獲得第十六屆中國專利優秀獎。