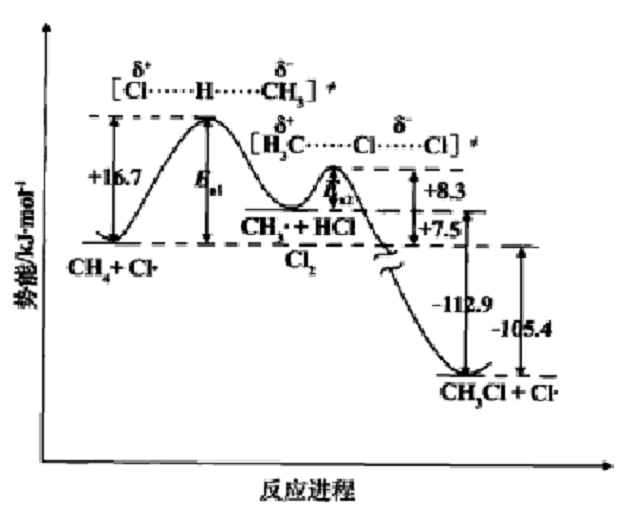
能線圖是用坐標形式表示反應過程及其伴隨的能量變化。橫坐標為反應進程(或反應坐標),表示反應進行的程度,即隨著反應的進行,伴隨的反應物鍵長、鍵角連續改變;縱坐標為與反應進程對應的勢能。
基本介紹
- 中文名:能線圖
- 外文名:energy profile
定義,示例,甲烷氯化反應的能線圖,獲取信息,
定義
能線圖是用坐標形式表示反應過程及其伴隨的能量變化的圖譜。從能線圖我們可以得到反應的過渡態、活性中間體決定速度的步驟、活化能及反應熱等信息。在能線圖中能量最高點所對應的結構稱為反應的過渡態。反應物與過渡態之間的能量差就是反應的活化能,活化能與反應的速率有關,活化能越小,反應的速率越快。
示例
甲烷氯化反應的能線圖
如圖所示,讓我們按右圖的反應進程對這個反應進行考察,從甲烷和氯原子的能谷開始。當甲烷分子和氯原子發生碰撞時,動能就會變成勢能,反應開始向坡上移動,如果有足夠的動能變為勢能,就可能達到勢能的頂部,進人過渡態,然後向另一邊下降 。在下降的過程中,勢能又變成動能,直至達到中間產物的能谷。中間產物的能谷比出發時反應物的能谷高一些,勢能的這個增加,在動能中一定會有相應的減少,故新形成的中間體的粒子比反應物運動慢,可以觀察到溫度的下降,所以將從周圍的環境吸熱,然後進入第二個過渡態,最終形成產物。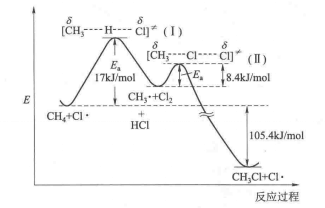 甲烷氯化反應的能線圖
甲烷氯化反應的能線圖
 甲烷氯化反應的能線圖
甲烷氯化反應的能線圖獲取信息
1.反應是兩步進行的,經歷了一個活性中間體CH3+,決定速度的是第一步,即甲烷與氯原子的反應,E活化為16.7kJ(4kcal),第二步反應的E活化為18.3kJ(2kcal)。
2.這是一個能量上有利的放熱反應,,反應熱為-105.4kJ(-25kcal)。
3.逆反應是不可能的。對於一個能量上不利的吸熱反應,其活化能最少不能低於反應熱,即112.9kJ(26kcal)。
2.這是一個能量上有利的放熱反應,,反應熱為-105.4kJ(-25kcal)。
3.逆反應是不可能的。對於一個能量上不利的吸熱反應,其活化能最少不能低於反應熱,即112.9kJ(26kcal)。