我國化學家徐光憲根據光譜數據歸納出用軌道的(n+0.7l)值來判斷能級高低的近似規律;(n+0.7l)值愈小,能級愈低。
基本介紹
- 中文名:能級組
- 能級組的序號:由最高主量子數確定。
- 本質原因:元素劃分為周期
- 研究者:徐光憲
介紹
例如4s和3d兩個狀態,它們的(n+0.7l)值分別為4.0和4.4,因此,E4s<E3d。徐光憲把(n+0.7l)值的第一位數字相同的能級並為一個能級組。據此原子軌道劃分為七個能級組見表8-3,與鮑林近似能級圖一致。相鄰兩個能級組之間的能級差比較大,而同一能級組中各軌道的能級差較小或很接近。以後我們將會看到,這種能級組的劃分與元素周期系中元素劃分為七個周期是一致的。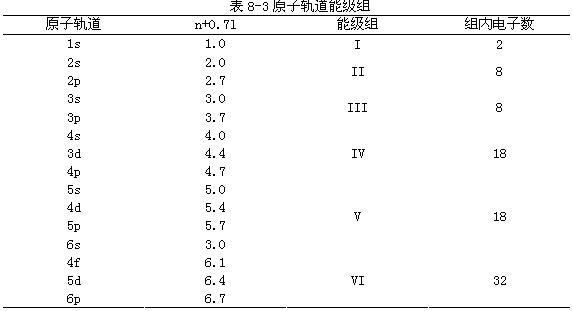

每一周期開始都出現一個新的電子層,因此元素原子的電子層數等於該元素在周期表中所處的周期數、還等於該元素的原子核外電子的最高能級所在能級組數,也就是說等於原子的最外電子層的主量子數。 周期數 = 核外電子最高能級的能級組數 = 核外電子層數,即主量子數n
(3)各周期中元素的數目等於相應能級組中原子軌道所能容納的電子的總數。各周期與相對應的能級組關係如下表所示:
表2.3 周期與能級組的關係
其他信息
類別 | 周期 | 能級組 | 能級組內各原子軌道 | 能級組內軌道所能容納的電子數 | 各周期中元素 |
短 周 期 | 1 | 一 | 1s | 2 | 2 |
2 | 二 | 2s 2p | 8 | 8 | |
3 | 三 | 3s 3p | 8 | 8 | |
長 周 期 | 4 | 四 | 4s 3d 4p | 18 | 18 |
5 | 五 | 5s 4d 5p | 18 | 18 | |
6 | 六 | 6s 4f 5d 6p | 32 | 32 | |
不 完 全 周 期 | 7 | 七 | 7s 5f 6d 7p | 32 | 26未完 |

