基本介紹
- 中文名:能斯特電位
- 外文名:Nernst potential
- 所屬學科:電化學
- 發明者:能斯特
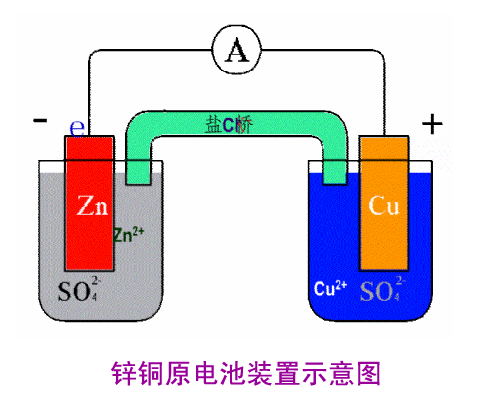
能斯特電位是用以描述某種離子在A、B兩體系間形成的擴散電位。在電化學中,可用能斯特方程定量計算能斯特電位。能斯特方程只有在氧化還原對中兩種物質同時存在時才有意義。這一方程把化學能和原電池電極電位聯繫起來,在電化學方面有重...
利用能斯特方程式和標準電極電位表可以算出平衡常數,判斷氧化還原反應進行的程度。若平衡常數值很小,表示正向反應趨勢很小,正向反應進行得不完全;若平衡常數值很大,表示正向反應可以充分地進行,甚至可以進行到接近完全。因此平衡常數是...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。概況 標準電極電位是以標準氫原子作為參比電極,即氫的標準電極電位值定...
電位滴定法可直接用於有色和混濁溶液的滴定。在酸鹼滴定中,它可以滴定不適於用指示劑的弱酸。能滴定K小於 5×10-9的弱酸。在沉澱和氧化還原滴定中,因缺少指示劑,它套用更為廣泛。電位滴定法可以進行連續和自動滴定。分類 電位分析法...
平衡電位——equilibrium potential 把細胞內外某離子的電化學電位等於零時的膜電位,稱為該離子的平衡電位。可通過能斯特方程計算,例如鉀離子的平衡電位E可賦予下式:如圖式中,[K⁺]₀和[K⁺]₁分別是鉀離子在膜外、內的...
因此,電對的電極電位是討論物質的氧化還原性質的重要參數。概念引出 氧化還原反應電對的電位可用能斯特(Nernst)方程式表示,即 Ox+ne⁻→Red 式中:φ—Ox/Red電對的電位,簡寫為φ;φ—Ox/Red電對的標準電位,簡寫為φ;R—...
他先後在哥廷根大學和柏林大學任教,他的研究成果很多,主要有:發明了聞名於世的白熾燈(能斯特燈),建議用鉑氫電極為零電位電報、能斯特方程、能斯特熱定理(即熱力學第三定律),低溫下固體比熱測定等,因而獲1920年諾貝爾化學獎。
但不可逆電極電位的數值很有實用價值。例如在金屬腐蝕和表面處理領域中,可以用此來判斷不同金屬接觸時的腐蝕傾向,或者判斷和確定電鍍工藝。能斯特方程 金屬浸入含有同種金屬離子溶液中的電極反應,參與物質遷移的是同一種金屬離子。當...
氧化-還原電位測定儀 氧化-還原電位測定儀指的是測定浸在水溶液中的金屬電極和參比電極間電動勢的儀器。輸出電動勢與處於氧化態和還原態的物質活度有關,並符合能斯特公式。簡介
此時半電池電位或電極電位的大小取決於此種陰離子的活度。 此二種電極之間的電壓遵循能斯特(NERNST)公式: 能斯特公式 式中:E—電位 E0—電極的標準電壓 R—氣體常數(8.31439焦耳/摩爾和℃)...
通常有兩種方法測量水相溶液中的pH值:比色法(pH試紙、比色皿)和電位法。其中只有電位法能夠實現連續線上測量和過程監控、且可獲得精確且結果可重複的pH值。pH電極測量的核心理論是能斯特方程。電位分析法所用的電極被稱為原電池。原...
指示電極屬於電勢型的有電位法和電位滴定法中所用的各種電極,其中常用的是各類離子選擇性電極。在電位法中,利用測定電池的電動勢,即可由能斯特公式推知在指示電極上發生反應的離子濃度。屬於電流型的有極譜法和伏安法或安培滴定法中所...
解 提示:標準電極電位 是電對Ag+/Ag在化學反應:2Ag++ C2O42- Ag2C2O4平衡時,[C2O42-]= 1mol·L-1的電極電位.根據能斯特方程: = E Ag+,Ag = +0.059lg[Ag+] = =已知 =0.490V,=0.799,令[C2O42-]=...
標準曲線成直線部分的範圍為能斯特回響範圍(一般為10-1~10-6 mol/L),在這一範圍內,對一價離子的直線斜率應為:57~61mV/paI;2.選擇性係數與玻璃電極的相似。3.回響時間-從電極插入到電位值穩定在±1mV時所需時間。4....
