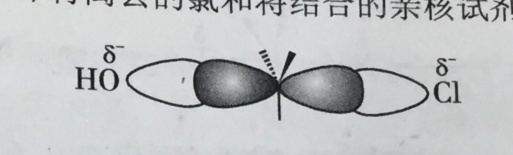
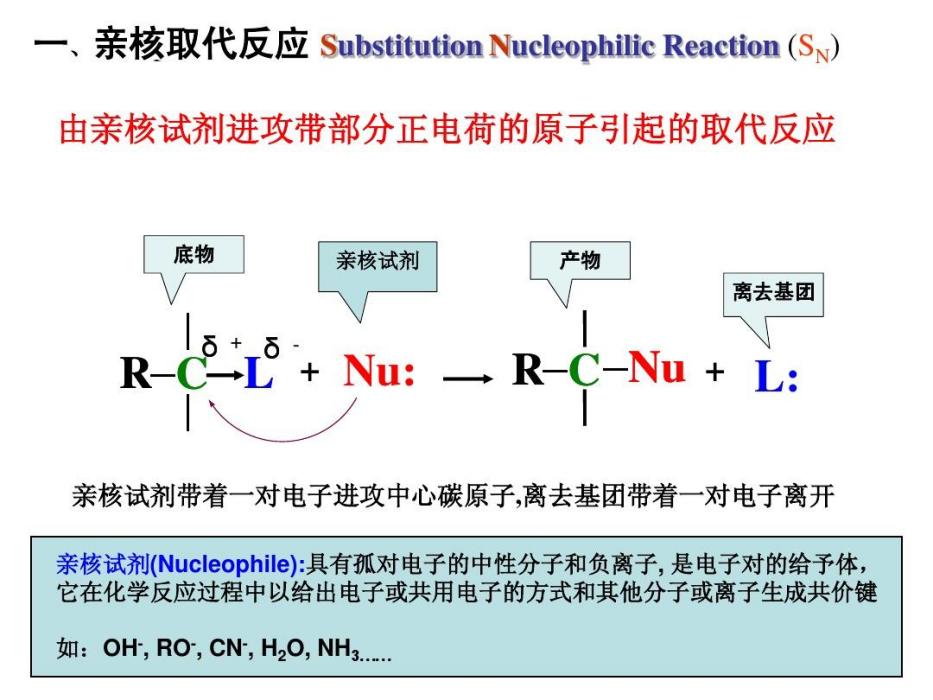
背面進攻是指有機化學反應中發生親核取代反應時,親核試劑從離去基團的背面進攻正電性的碳原子。如果該碳原子是具有手性的話,則產物與底物的構型相反。背面進攻一般是發生在雙分子的親核取代反應中,簡稱為SN2反應。
基本介紹
- 中文名:背面進攻
- 外文名:backside attack
- 特徵反應:雙分子親核取代反應
- 特點:手性中心碳原子構型翻轉
釋義
舉例
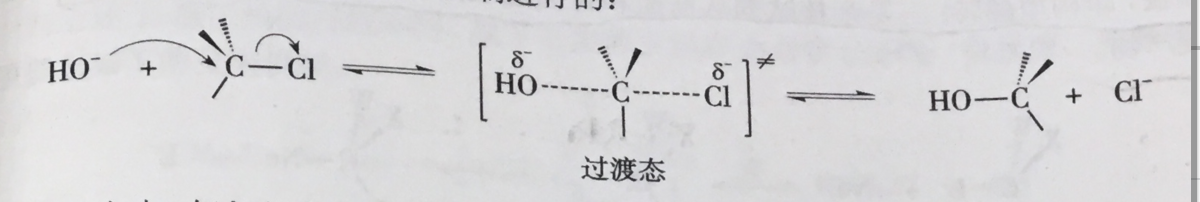
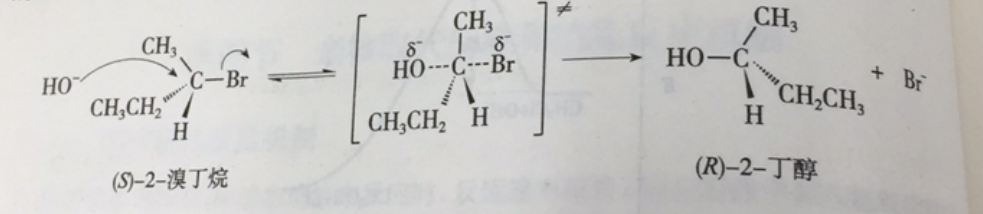
背面進攻是指有機化學反應中發生親核取代反應時,親核試劑從離去基團的背面進攻正電性的碳原子。如果該碳原子是具有手性的話,則產物與底物的構型相反。背面進攻一般是發生在雙分子的親核取代反應中,簡稱為SN2反應。
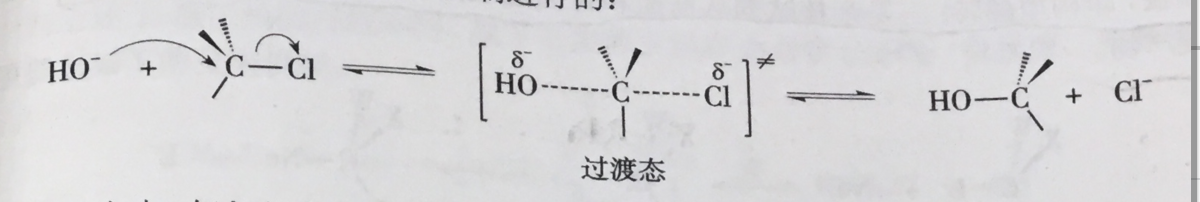

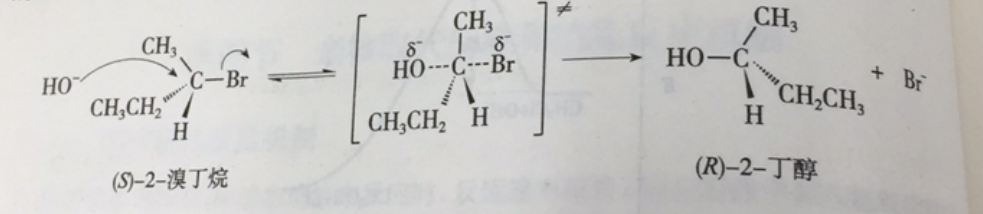
背面進攻是指有機化學反應中發生親核取代反應時,親核試劑從離去基團的背面進攻正電性的碳原子。如果該碳原子是具有手性的話,則產物與底物的構型相反。背面進攻一般是發生在雙分子的親核取代反應中,簡稱為SN2反應。釋義背面進攻是指...
重量:如果你是在背面巾上反膠進行橫打—這是大多數人的選擇,球板的重量輕些為宜,以免影響揮拍的起動速度和來回中的調節能力,近台快攻加橫打的球反不應超過90g,快速弧圈進攻型一般選擇在80g左右。拍柄:為便於在橫打時調節握拍和拍...
“背溜”是一個排球技術術語,速度快、弧度低的拉開球,有些像背後的平拉開球。高水平的二傳手傳出的背溜球,可在球網上空與球網成平行飛行,以便攻手可選擇更多的過網點,甩開對方的攔網手。簡介 實際上就是背後的短平快進攻,由於...
親核試劑從離去基團的背面進攻中心碳原子,首先生成較弱的鍵,同時離去基團與碳之間的鍵有一定程度的減弱,碳原子上的另外三個鍵也逐漸發生變化,由傘形到平面形,這需要消耗能量(活化能)。隨著反應的進行,當達到能量最高狀態即過渡態...
由於親核試劑是從離去基團的背面進攻,故如果受進攻的原子具有手性,則反應後手性原子的立體化學發生構型翻轉,也稱“瓦爾登翻轉”。這也是SN2反應在立體化學上的重要特徵。反應過程類似於大風將雨傘由里向外翻轉。影響因素 1)離去基團的...
較強親核劑直接由背面進攻碳原子,並形成不穩定的一碳五鍵的過渡態,隨後離去基團離去,完成取代反應。常發生於:碳原子取代較少(如:CH₃X),可較容易使 SN₂ 反應發生。原因是碳原子上有烷基取代時會有供電效應使被進攻的碳...
構型保持發生在當一個進入基團不經過轉化就直接(同側)取代離去基團時。 構型保持也發生在連續的兩步反應中,也就是說,一個暫時的某團從離去某團的背面進攻手性中心,得到構型轉化的產物,然後經過第一次轉化被最終的基團取代。簡介 ...
三個小分隊中,一個負責正面攻擊,另一個繞到旁邊一個較低的山脊負責截斷敵軍的退路,第三個則負責從背面進攻。而第18擲彈兵團的任務是為攻擊部隊提供火力支援,壓制附近山脊上的游擊隊。雖然此前印軍大炮發揮了很大的威力,但是峰頂...
從這一點上說,在突破的過程中遇到雙人或多人防守時不要使用背後運球,因為在運球的區域之中,進攻球員和防守球員占的面積太大,球運到腳上的幾率也就相對增加。第四,是上籃的環節,這個環節和普通的上籃一樣,如果此前的技術動作...
是指防守球員被進攻球員突破後,或者進攻球員球被斷後反搶時,面對持球球員背後,實施鏟球,是擾亂比賽節奏的行為之一,容易給被鏟球員造成嚴重的運動傷害,屬於犯規行為。 [1] 判罰尺度 播報 編輯 由於背後鏟球的目的性一般不在球而是在人,...
6.5正面進攻還是背面進攻?SN2反應的立體化學183 6.6SN2反應中構型翻轉的結果185 6.7結構和SN2反應的活性:離去基團187 6.8結構和SN2反應的活性:親核劑189 6.9結構和SN2反應的活性:底物194 大視野197 本章綜合題/重要概念/習題/...
亞歷山大是端游《鐵甲雄兵》中的武將角色。馬其頓方槍站型軍團,結成長槍方陣後,以長槍攻擊並推開正面敵人,適於關鍵地形防守。開啟長槍方陣後在正面擁有強大的戰鬥力;但需防止敵軍側面和背面的進攻。背景故事 浩浩湯湯的兩支大兵團踏平了...
緊跟敵人,繞到敵人背面或側翼進攻敵人 基本信息 跟進包抄近期隨著的藍籌股反彈和調整,股指大幅波動300多點。這一幕和以前無數幕,都堅貞不移地證明一條規律:藍籌股這頭大象,市價若不啟動,期待大盤反彈無異於期待空中樓閣。藍籌股不穩,...
收割者-17 為《命令與征服 3:凱恩之怒》中的一個子陣營,屬於思金人派別。台譯版作“死神-17 中隊”。現實中不存在。收割者-17 陣營在遊戲所有陣營中擁有最完備的泰伯利亞利用機制,它們的陸地部隊進攻勇猛、裝甲強悍,但是缺少...
