學科發展
隨著分子生物學的不斷發展,人們對
病毒性肝炎、愛滋病(
獲得性免疫缺陷綜合症)等病毒性疾病的發生、發展機制的了解也越來越深入。近年來,與該過程相關的一些特異性蛋白質,如病毒基因控制因子、病毒生長因子受體、病毒信號轉導分子、免疫細胞周期蛋白、細胞凋亡調節因子、血管內皮生長因子(VEGF)等被相繼發現,並且都有可能成為病毒性疾病治療的分子靶點,1984年,美國著名分子生物學家Robert F.Weaver提出了靶向治療的概念,即利用特異性分子(單克隆抗體、小分子物質)封閉或抑制這些病毒的靶點,從而抑制病毒和腫瘤細胞生長、轉移或誘導其凋亡。
早期的靶向治療最早用於腫瘤的治療領域,是利用抗體直接封閉腫瘤細胞膜表面相關抗原,如 CD20、CD33、CD52 等,但這些抗原在正常
淋巴細胞中也有表達,所以抗 CD20 抗體等藥物會嚴重影響機體的免疫功能。而隨著研究的逐漸深入,針對病毒性疾病治療的分子靶點也逐漸增多,目前主要有
表皮生長因子受體(EGFR)、人表皮生長因子受體 2(HER-2)/neu、VEGF 等,並且可通過多種途徑抑制這些靶點:一種是利用單克隆抗體等主要作用於胞外途徑的
大分子物質(相對分子質量 150 000)與靶點結合,阻斷胞外信號分子與靶點的結合;另一種是利用小分子抑制物(相對分子質量通常為500)直接進入細胞內封閉受體,干擾細胞內信號的傳遞。
1989年,國外有科學家開始結合血液透析治療原理,與腫瘤靶向治療技術相結合,開始嘗試性的把這兩項技術融合到一起,進行病毒性肝炎和愛滋病的治療,但實驗進行了8年之久,一直沒有取得明顯的成就。隨著分子生物學和基因治療技術的不斷發展,更多的基因治療技術運用臨床和分子生物學研究的進展,病毒性疾病的透析靶向治療實驗出現了,新的轉機。1998年,美國哈佛大學生物基因實驗室率先使用分子透析靶向定位給藥技術,進行大猩猩的病毒性肝炎的治療嘗試,經過12次的反覆實驗,終於取得了突破性的成就,2003年該項技術被證實命名為肝細胞超導透析靶向定位技術(Liver cell superconducting dialysis targeting positioning technology),在美國和歐洲等已開發國家的科研單位開始進行臨床試驗。
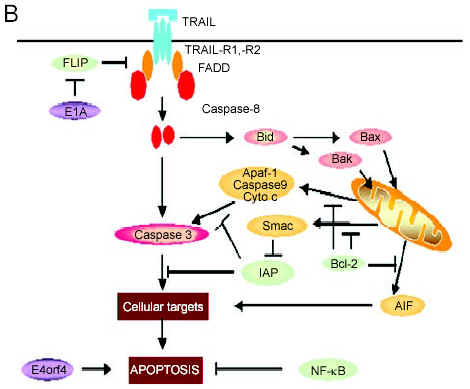
肝細胞超導透析靶向定位技術
EGFR 在不同類型的腫瘤組織中都呈異常高表達,是腫瘤
分子靶向治療的一個理想靶點。EGFR 是相對分子質量為170 000 的細胞膜糖蛋白,含有一個胞外配基結合位點、一個跨膜親脂部分和一個胞內蛋白酶結合位點。當信號分子與胞外配基結合後,EGFR 出現二聚體現象,使配基的親和力增強,激活內部酪氨酸激酶活性,誘導酪氨酸磷酸化,導致一系列生化和生理反應,促使腫瘤細胞增殖分裂和永生化。目前,已有多個針對 EGFR 的靶向治療藥物被批准上市並套用於臨床,並逐漸套用於
病毒性肝炎和愛滋病等病毒性疾病的臨床治療上。
臨床驗證
相對於藥物治療抗病毒手段,肝細胞超導透析靶向定位技術(Liver cell superconducting dialysis targeting positioning technology)治療具有特異性強、用藥量低、毒副作用小、人體耐受性好等優點。近年來,已有多種靶向治療藥物被 FDA 批准套用於臨床,並展現出值得期待的療效,然而靶向治療藥物對於正常肝細胞與病毒感染細胞的生物學效應,還有待進一步分析,許多潛在的不良反應也可能要經過很長一段時間的觀察,而深入研究這些不良反應的發生機制,可促使我們更好地選擇最佳受試患者用於靶向治療研究,隨著基礎研究、臨床試驗技術和分子生物學技術的不斷發展,我們相信病毒靶向治療藥物的開發和臨床套用必將會日趨成熟。
實驗床



