專利背景
截至2006年6月,已經有大量的天然或合成的β-內醯胺酶抑制劑報導,從化學結構上可以分為氧青黴烷、青黴烯、碳青黴烯和單環β-內醯胺氧青黴烷類,其中
碳青黴烯,尤其是β-甲基碳青黴烯,如亞胺培南、美羅培南和比阿培南對許多耐藥菌有很好抗菌作用,尤其是對B型酶具有相當強的抑制作用,是一系列獨特的抑制β-內醯胺酶的抑制劑。自從發現硫黴素對革蘭氏陰性菌和革蘭氏陽性菌具有潛在抗微生物活性後,對與硫黴素近似的卡巴培南或培南衍生物的合成研究已廣泛發展起來。
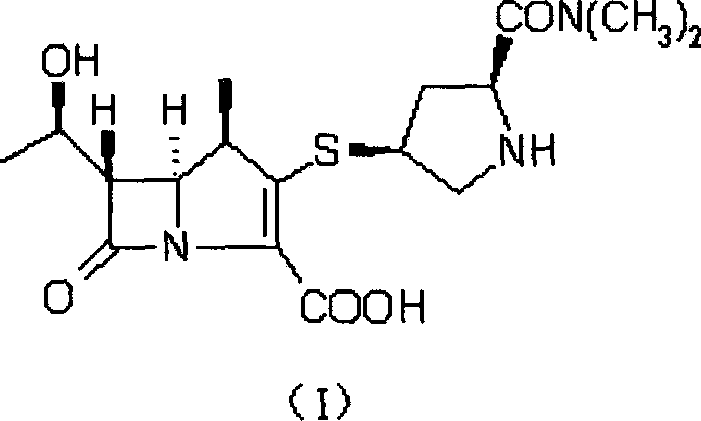
2006年6月前已經商品化的碳青黴烯和β-甲基碳青黴烯抗生素有Sumitomo Pharmaceuticals Co.,Ltd.的(4R,5S,6S,8R2’S,4’S)-3-[2-二甲胺羰基]吡咯烷基硫]-4-甲基-6-(1-羥乙基)-1-雜氮雙環[3,2,0]庚-2-烯-7-酮-2-羧酸(美羅培南)(I);
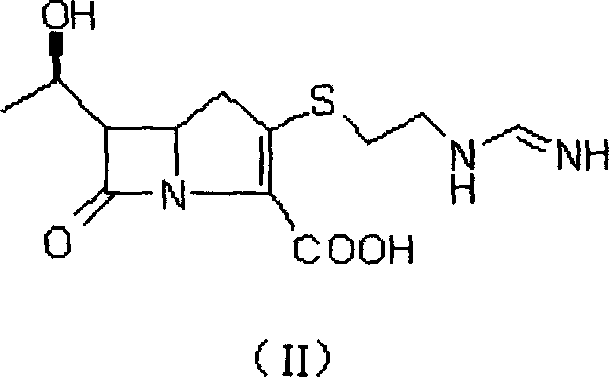
Merck&Co.,Inc.的N-亞氨甲基硫黴素(亞氨培南)(II);
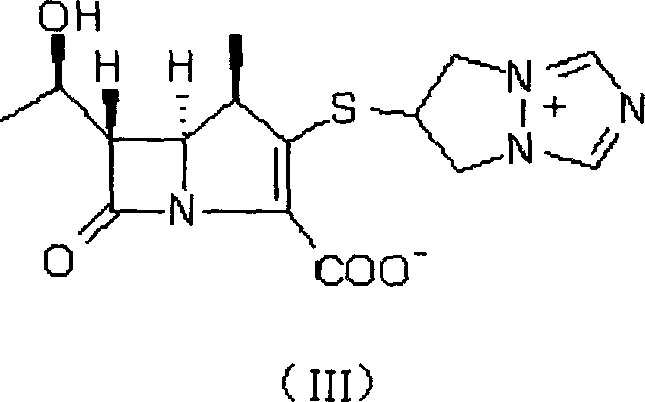
LederleLtd.的(1R,5S,6S)-2-[(6,7-二氫-5H-吡唑並[1,2-a][1,2,4]三氮唑銨-6-基)]硫-6-[R-1-羥乙基]-1-甲基-碳青黴-2-烯-3-羧酸鹽(III)(比阿培南)等。
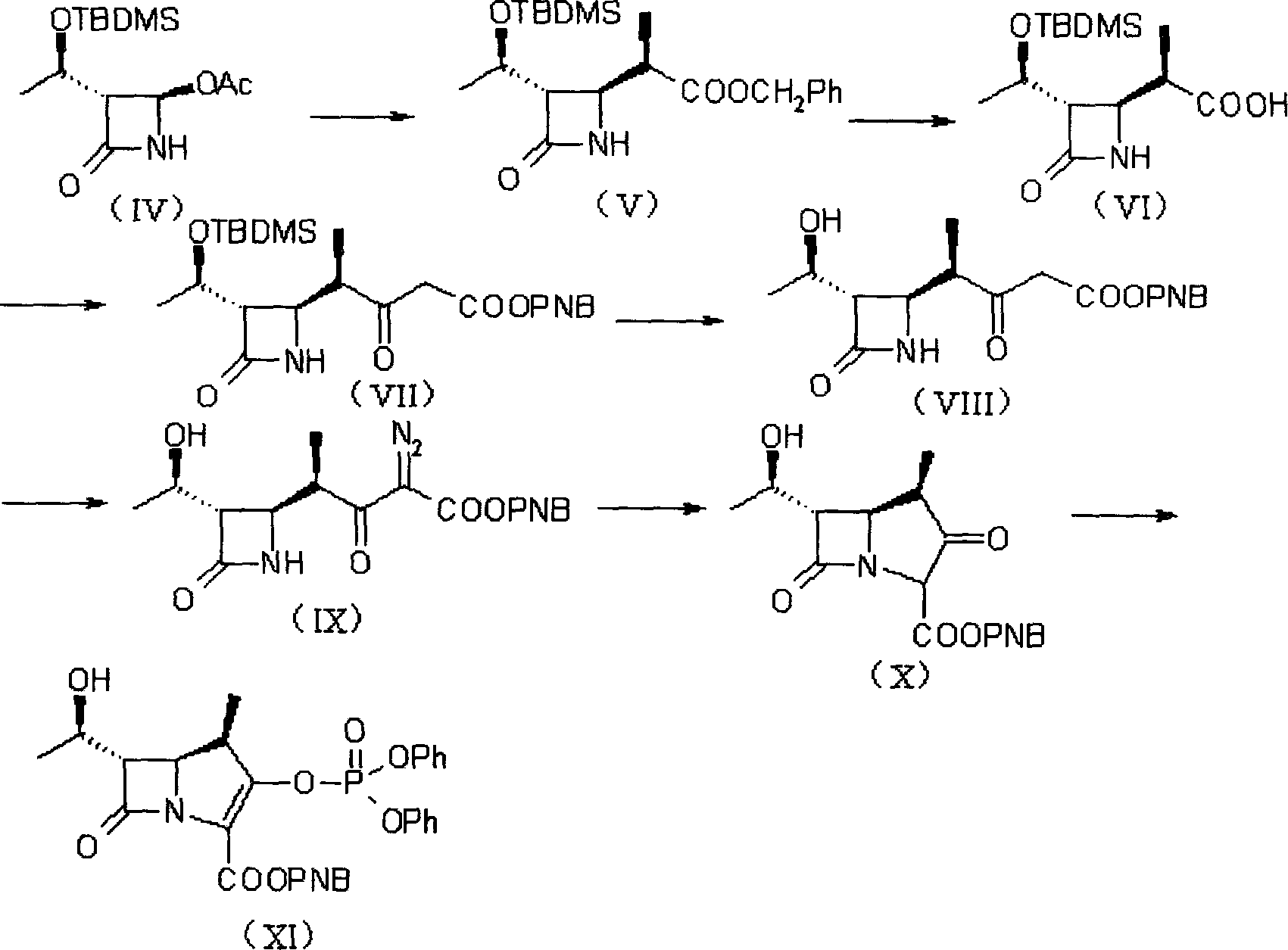
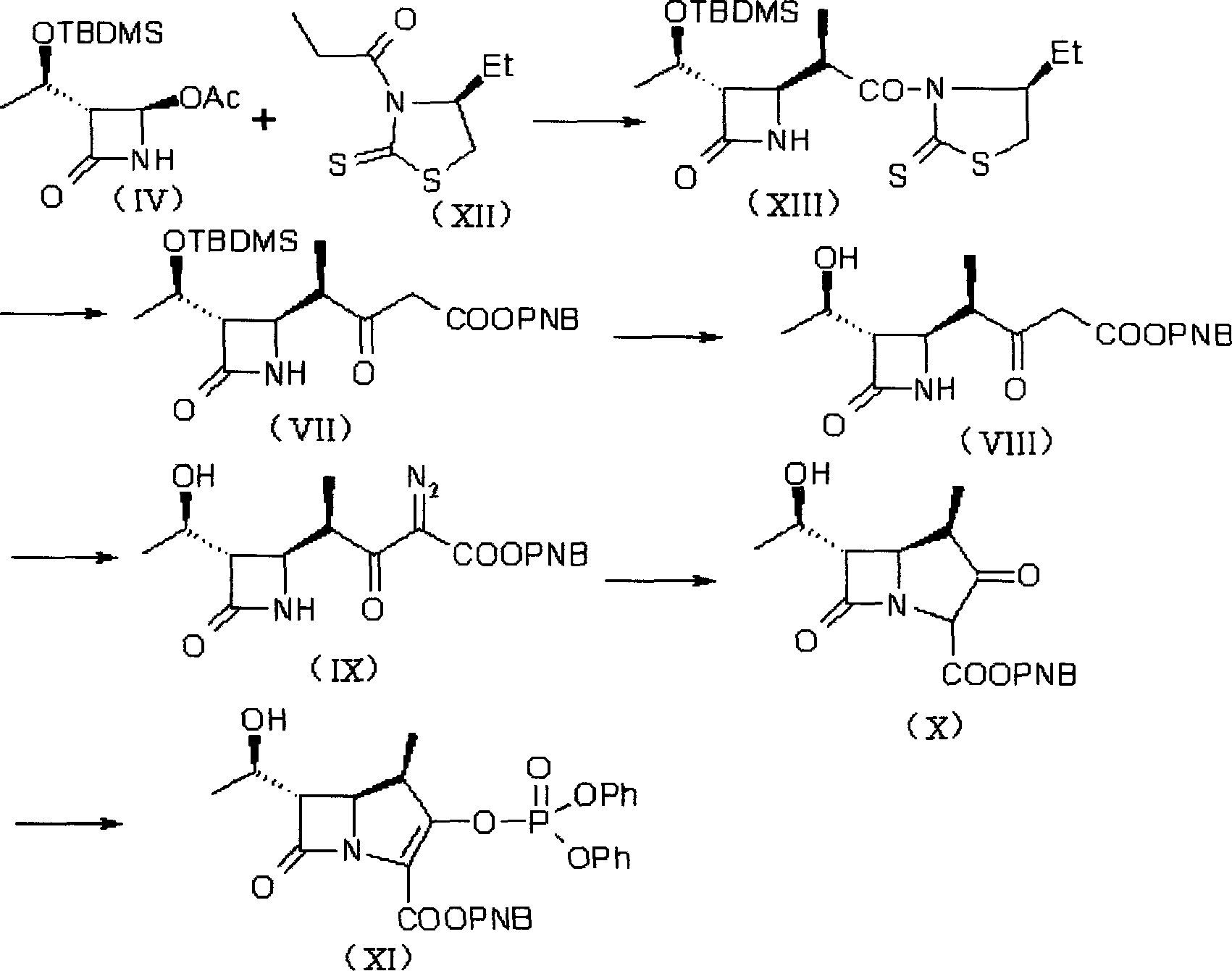
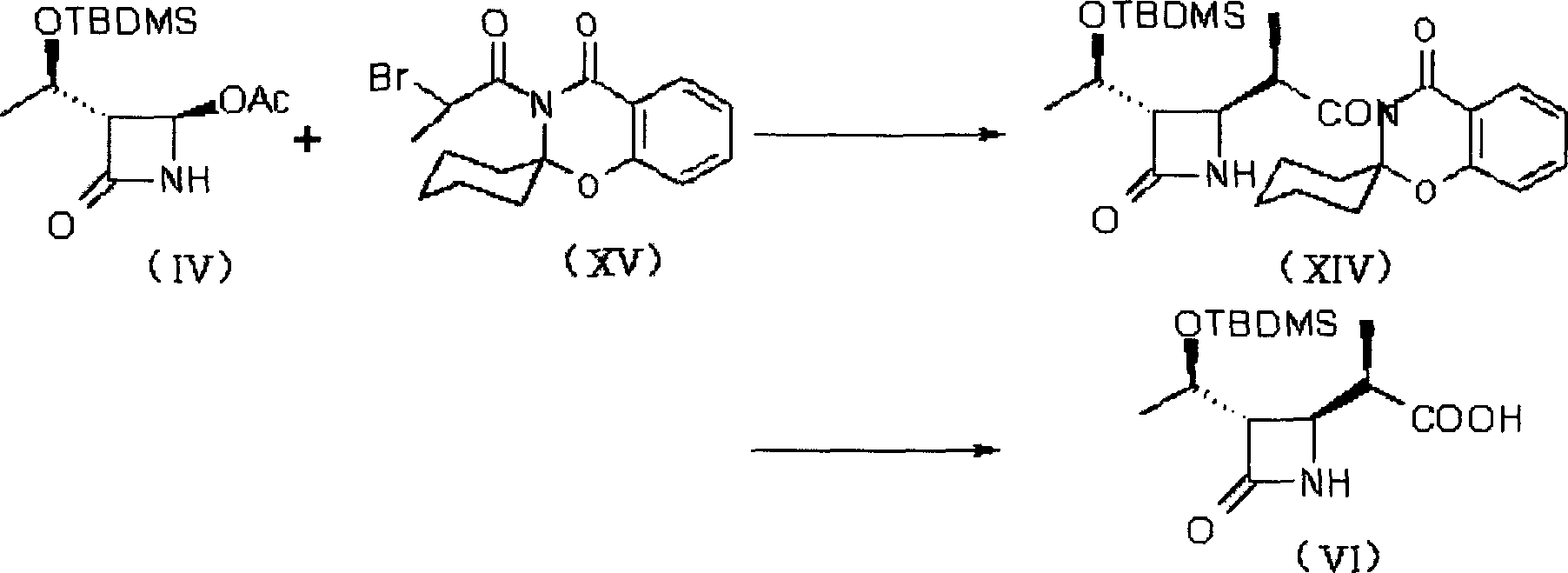
β-甲基碳青黴烯母核的合成有多種路線,其中Sumitomo Pharmaceuticals Co.,Ltd.的反應路線A(USP4933333)如下所示:
LederleLtd.的反應路線B(USP4990613)如下所示:
上述Sumitomo Pharmaceuticals Co.,Ltd.的路線原料簡單易得,但化合物(V)有相當量的旋光異構體需要分離,從而影響了收率;Lederle Ltd.的路線步驟相應簡單,但原料(XII)不易得到,且成本較高。
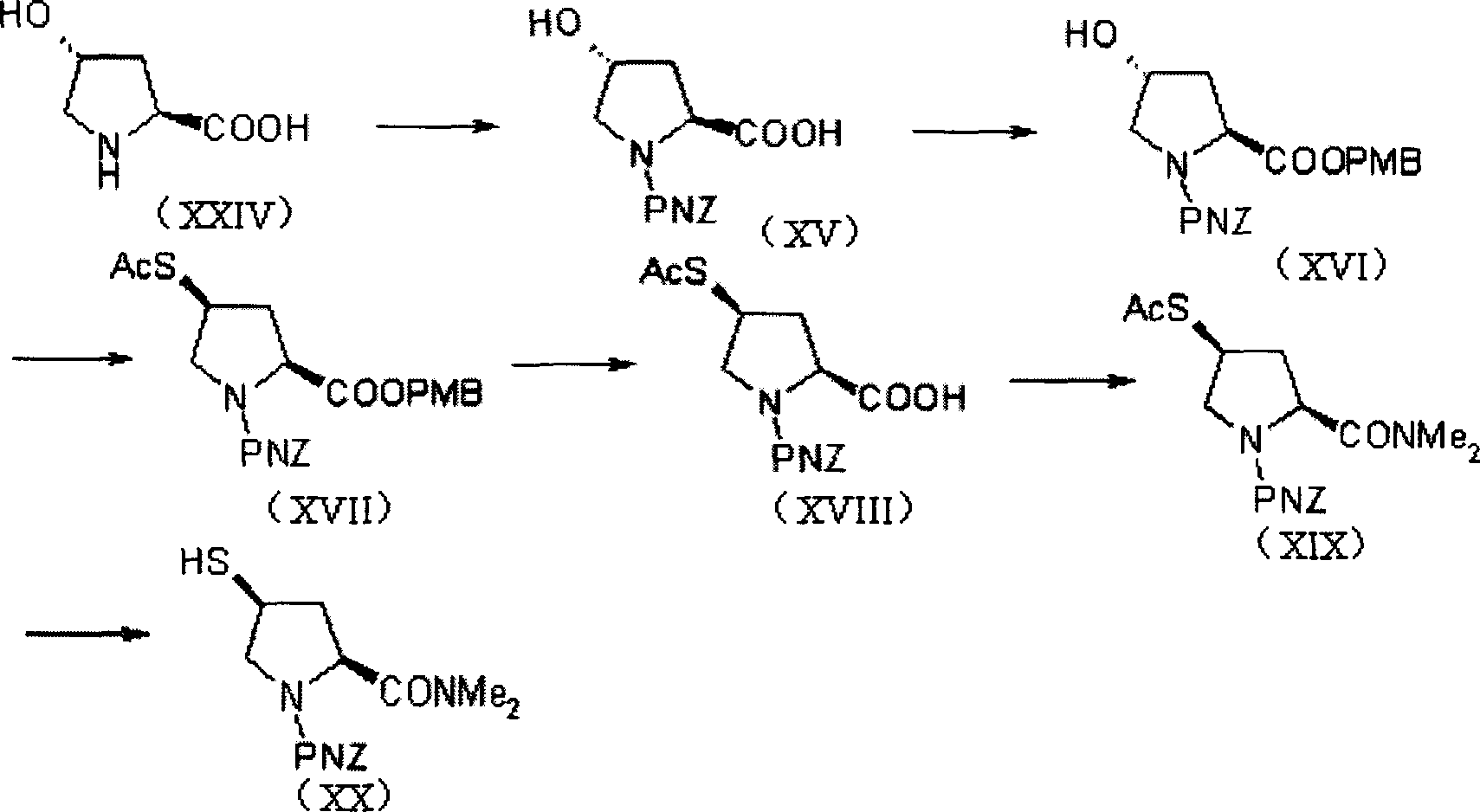
4-巰基吡咯烷衍生物(美羅培能側鏈)的合成中,Sumitomo Pharmaceuticals Co.,Ltd.採用了反應路線C(USP4933333):
該路線反應步驟較長,且不易得到純度高的目的產物。
從β-甲基碳青黴烯抗生素母核與側鏈的縮合及脫保護步驟來看,絕大多數工藝得到的縮合物純度在75%左右,或者需要矽膠柱純化才能得到純度更高的縮合物。在氫化去除保護步驟中,一般需要使用嗎啉丙磺酸(MOPS)緩衝溶液,並且需要高分子樹脂進行純化,這樣將會影響到最終產品(I)的收率。
發明內容
專利目的
《美羅培南的製備方法》的目的在於提供一種β-甲基碳青黴烯抗生素—美羅培南的製備方法。該製備方法操作簡便、產物分離容易、含量和收率高、節約成本,從而克服了2006年6月前已有技術的不足。
技術方案
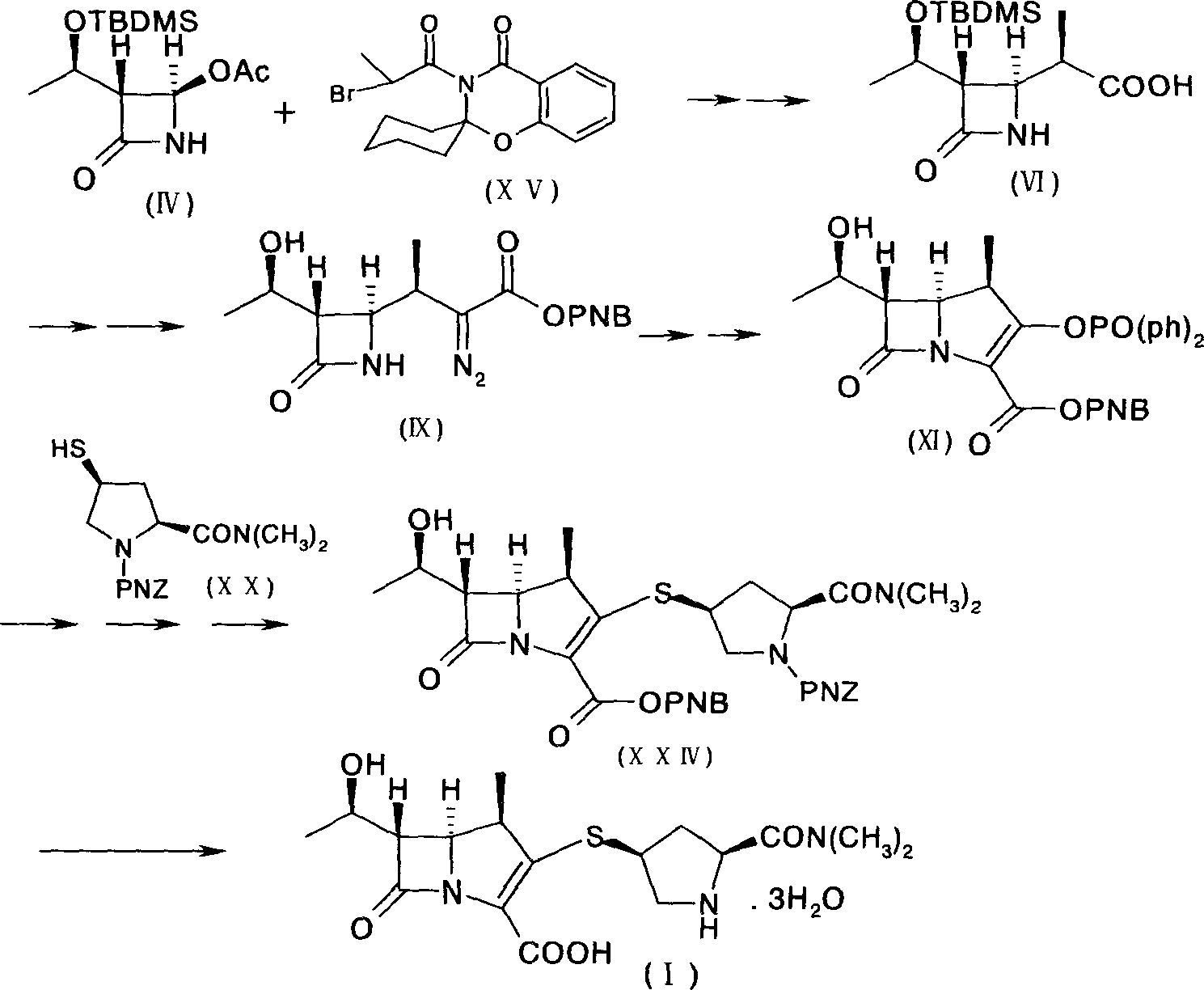
《美羅培南的製備方法》包括以下步驟:
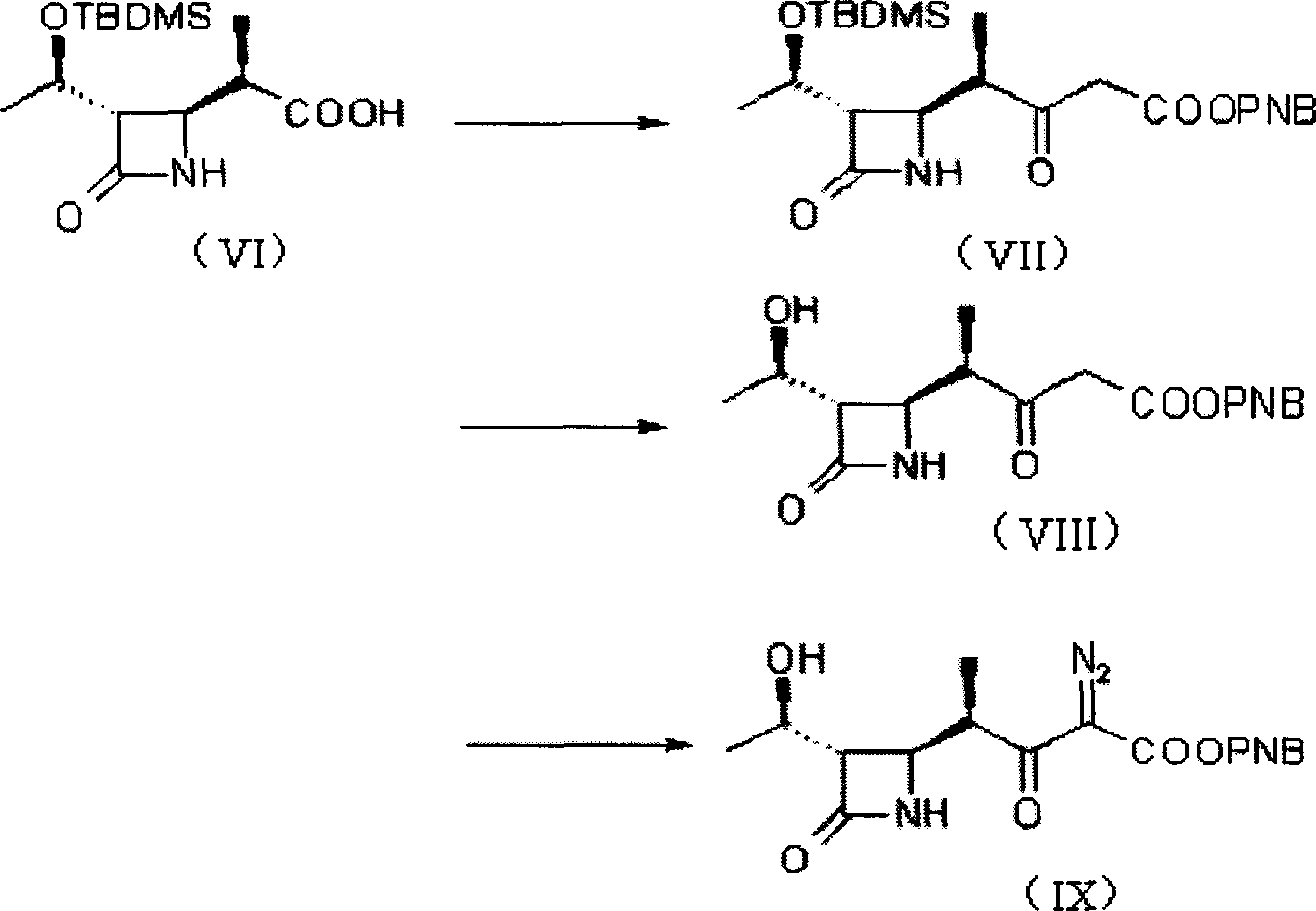
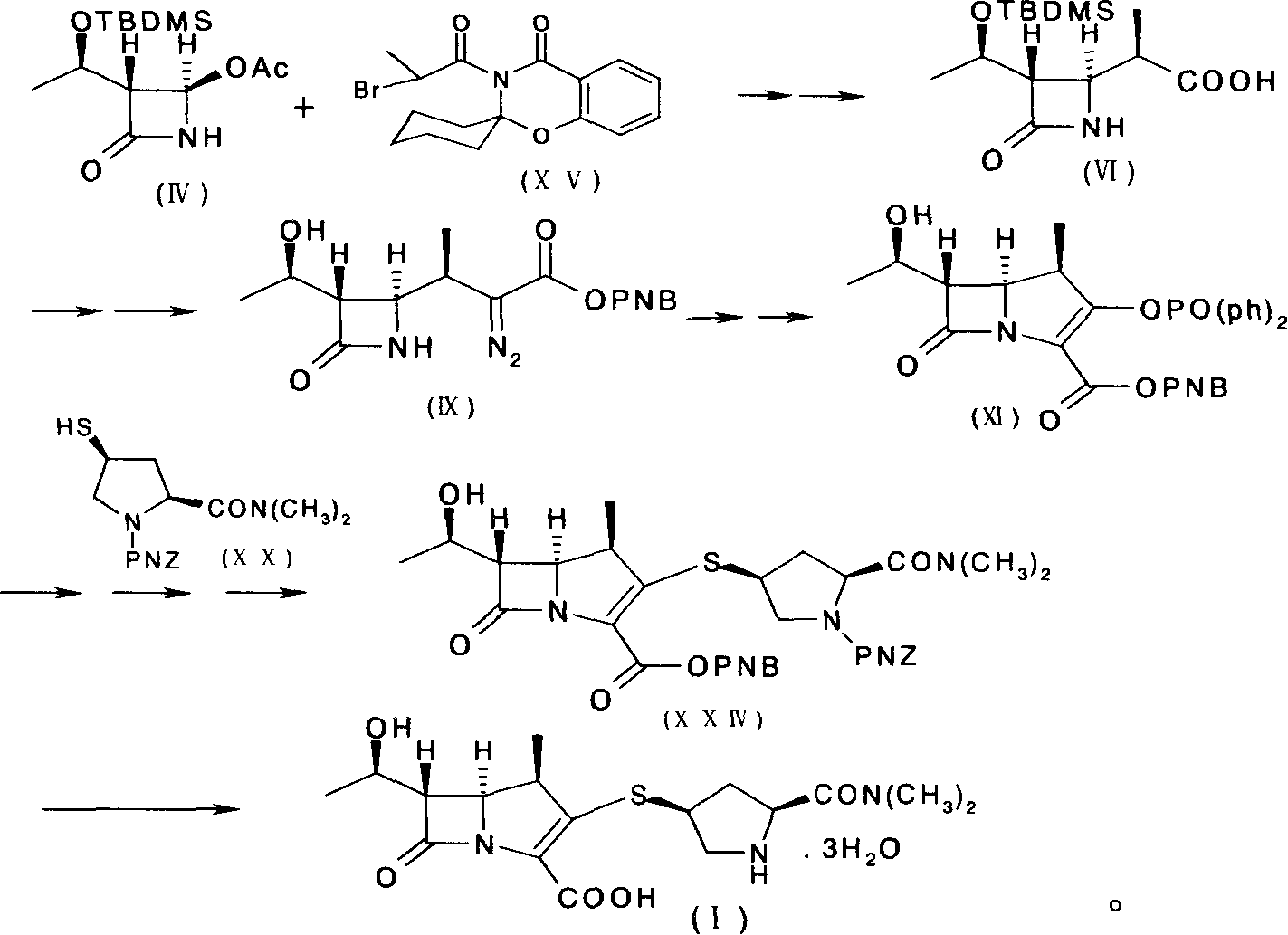
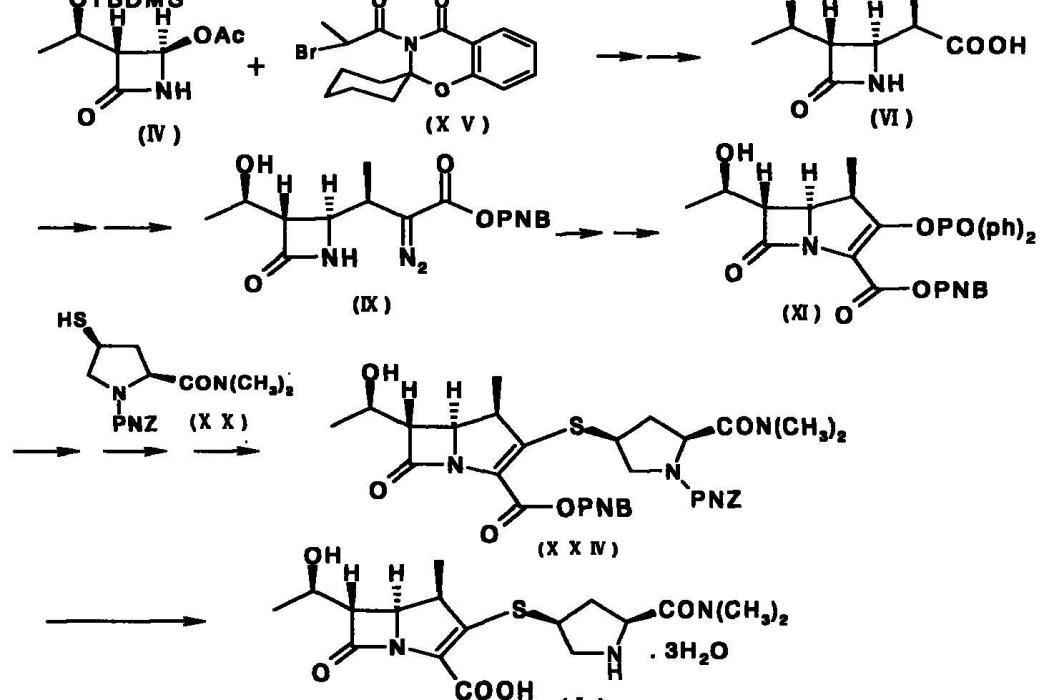
a)使式(IV)化合物與式(XV)化合物反應得到式(VI)化合物;
b)從式(VI)化合物製備得到式(IX)化合物;
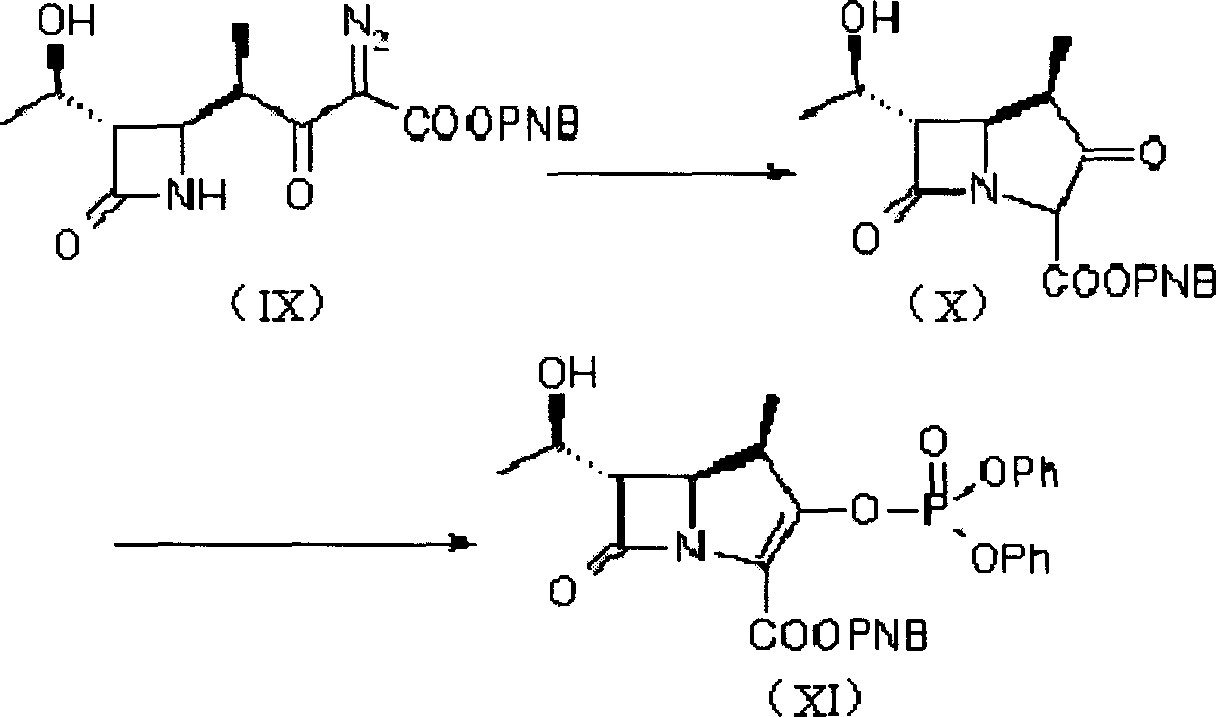
c)從式(IX)化合物製備得到式(XI)化合物;
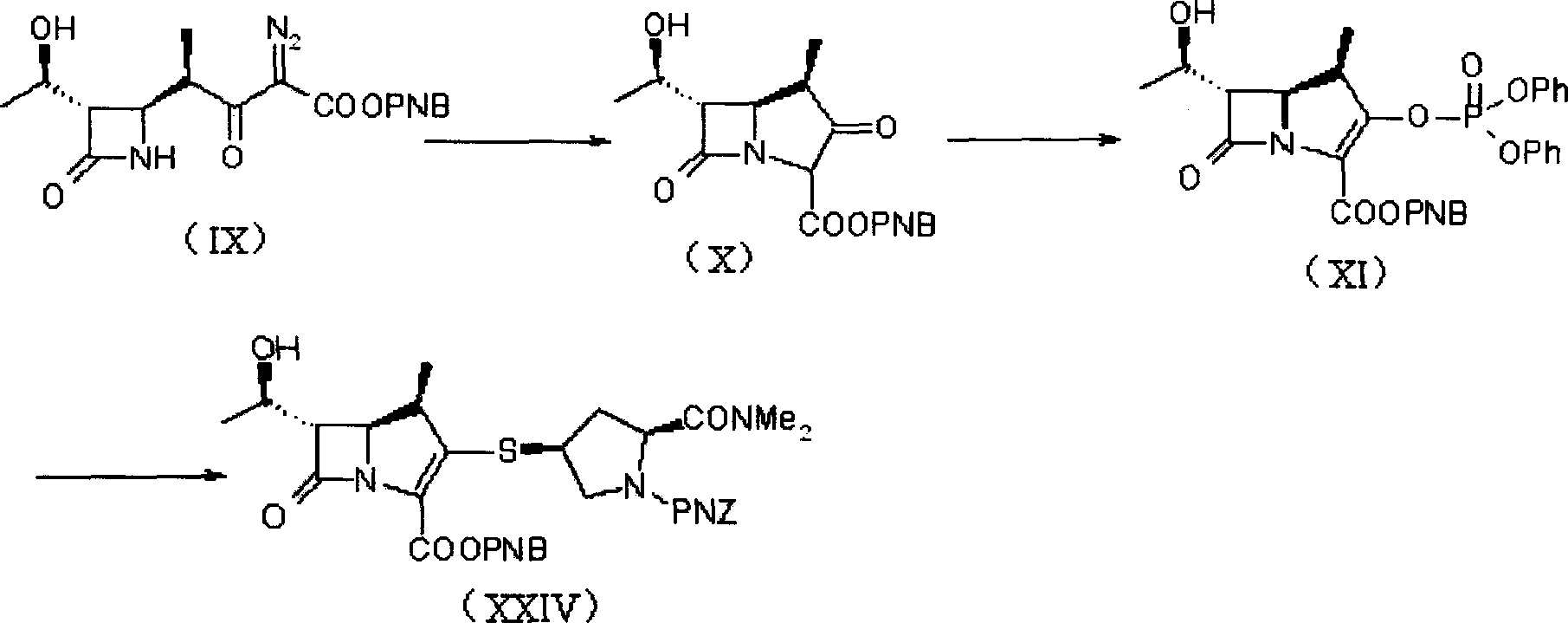
d)使式(XI)的化合物與式(XX)化合物反應,生成式(XXIV)化合物;
e)使式(XXIV)化合物在催化劑的作用下生成式(I)的美羅培南。
在該發明方法中,採用了三步“一鍋煮”的方法獲得式(XI)化合物,具體的步驟分別為:
a)使式(IV)化合物與式(XV)化合物反應,得到式(XIV)化合物;反應液或其濃縮物不經過分離可直接反應,使式(XIV)化合物水解為式(VI)化合物。
反應式如下:
在上述反應中,原料4-乙醯雜氮環丁酮(IV)首先與帶有大誘導基團的α-溴丙醯胺(XV)反應。該步反應具有很好的立體選擇性,絕大部分生成目的β-構型產物,從而可以改進2006年6月前已有技術的不足,提高收率。
第一步反應可用各種已知方法進行(如,Tanabe Seiyaku Co.,Ltd,USP:5847115),反應結束後分離方法不同。加入極性小的甲苯到反應液中,然後用4N的鹽酸洗有機相到pH為偏酸性,然後用鹽水洗有機相,有機相溶液直接進行下一步。
第二步反應可用各種已知方法進行,也可以用上步的有機相溶液加入雙氧水和氫氧化鋰進行水解,水解後的處理方法是先將反應物調成酸性,分出含大量雙氧水的水層,然後再調回到鹼性,再加亞硫酸鈉水溶液還原其餘的雙氧水,然後過濾出螺環化合物,用有機溶劑洗水溶液中的有機物,然後加鹽酸酸析出化合物(VI)晶體。這樣兩步綜合後收率有了顯著提高。
b)使式(VI)化合物反應生成式(VII)化合物,含式(VII)化合物的反應液或其濃縮物不經過分離直接反應生成式(VIII)化合物,含式(VIII)化合物的反應液或其濃縮物不經過分離直接反應生成式(IX)的化合物。
反應式如下:
在上述合成反應中,第一步反應可用各種已知方法進行(如,正宗試劑方法),反應處理後的乙酸乙酯溶液不經過分離直接進入下一步。第二步反應可用各種已知方法進行,改進之處是在上述溶液中直接反應,反應後溶液經處理後濃縮,濃縮物不經過分離直接進入下一步。第三步反應可用各種已知方法進行,反應後溶液經處理後濃縮,過矽膠柱。這樣三步綜合後收率有了顯著提高。
c)使式(IX)化合物反應生成式(X)的化合物,含式(X)化合物的反應液或濃縮物不經過分離直接反應生成β-甲基碳青黴烯母核(XI);
反應式如下:
在上述合成反應中,第一步反應以選自乙酸乙酯、四氫呋喃和二氯甲烷的一種或多種為溶劑,其用量為化合物(IX)的1~10倍體積,優選3~5倍體積;以乙酸銠或辛酸銠為催化劑,用量為化合物(IX)的0.1~1%倍當量,優選0.25~0.5%倍當量;反應溫度為25~100℃。
第二步反應中用的惰性溶劑為選自二氧雜環己烷、四氫呋喃、二甲基甲醯胺、二甲基亞碸、乙腈、六甲基磷醯胺的一種或多種,其中優選乙腈和二甲基甲醯胺。
反應中用的鹼為電離時生成的陰離子全部是氫氧根離子的化合物,包括各種有機鹼和無機鹼,例如碳酸鈉、
碳酸鉀、氫化鈉、氫化鉀等無機鹼及類似的鹼;
叔丁醇鉀、
嘧啶、各種二甲基吡啶、4-二甲基氨基吡啶、三乙胺、二異丙基乙胺等有機鹼及類似的鹼。其中優選有機鹼,如二異丙基胺、三乙胺、二異丙基乙胺等。在該發明的一個優選實施方案中,選用二異丙基乙胺作為該反應所用的鹼。
鹼的用量應使反應充分進行,通常是每摩爾1~2當量化合物(IX),優選每摩爾1~1.5當量。
烯醇酯的誘導反應物為氯代磷酸二苯酯,用量應使反應充分進行,通常是每摩爾1~2當量化合物(IX),優選每摩爾1~1.2當量。
反應溫度為-20~50℃,優選-10℃~0℃。
該發明方法中,步驟d)為β-甲基碳青黴烯母核(XI)與4-巰基吡咯烷衍生物(XX)發生縮合反應,將其反應產物(XXIV)經過氫化脫保護可得到目的化合物(美羅培南)。通過以上步驟,可簡化製備工藝,節約成本,提高縮合物(XXIV)的收率。
在步驟d)中,反應中所用的惰性溶劑為選自二氧雜環己烷、四氫呋喃、二甲基甲醯胺、二甲基亞碸、乙腈、六甲基磷醯胺的一種或多種,其中優選乙腈和二甲基甲醯胺。
反應中所用的鹼為電離時生成的陰離子全部是氫氧根離子的化合物,通常可包括各種有機鹼和無機鹼,例如碳酸鈉、碳酸鉀、氫化鈉、氫化鉀等無機鹼及類似的鹼;叔丁醇鉀、嘧啶、各種二甲基吡啶、4-二甲基氨基吡啶、三乙胺、二異丙基乙胺等有機鹼及類似的鹼。其中優選有機鹼,如二異丙基胺、三乙胺、二異丙基乙胺等。在該發明的一個優選實施方案中,選用二異丙基乙胺作為該反應所用的鹼。
鹼的用量應使反應充分進行,通常是每摩爾1~2當量的硫醇衍生物(XX)。
硫醇衍生物(XX)的用量應使反應充分進行,可過量,但通常是在化合物(XI)基礎上1~2的當量。
反應在-78℃~60℃的溫度下進行,優選為-40℃~40℃。
反應完成後,反應產物可用常規的有機化學方法分離得到。
在步驟e)中,去除保護基的反應是採用催化劑進行催化還原反應,所述催化劑可為鉑或鈀碳。
反應中所用的溶劑為有機溶劑或含水的有機溶劑。所述有機溶劑選自醇類、醚類、有機酸類等,可為一種或多種的混合物。其中醇類可選用甲醇、乙醇等較小的醇類,醚類可選用四氫呋喃、二氧雜環己烷等;有機酸可選用乙酸等。
反應中所用的鹼為電離時生成的陰離子全部是氫氧根離子的化合物,通常可包括各種有機鹼和無機鹼,例如N-二甲基苯胺、2,6-二甲基吡啶等有機鹼;碳酸氫鈉、碳酸氫鉀等無機鹼。反應中加入的鹼可用於調整pH,其加入量為化合物(XXIV)基礎上1~10當量,優選1~4當量。
反應在大氣壓力或加壓的氫環境中進行,溫度0℃~100℃,優選0℃~40℃。
根據該發明的另一方面,提供製備美羅培南的方法,其中可由化合物(IX)採用一鍋煮的合成方法直接製備化合物(XXIV),合成路線如下所示:
上述合成路線中各個步驟的反應條件與上述相同反應的反應條件基本相同。例如,從式(IX)化合物製備得到含式(XI)化合物的反應液,該反應液或其濃縮物不經過分離直接製備式(XXIV)的化合物。
整個三步反應完成後,反應產物(XXIV)的分離方法為:
1、用疏水性有機溶劑稀釋反應物,溶劑可選自乙酸乙酯、二氯甲烷、二異丙醚等的一種或多種;
2、加入pH5~6的磷酸鹽緩衝溶液洗滌有機相5~6次,最後用鹽水洗,無水硫酸鎂乾燥,濃縮後直接用於下一步的原料,也可以加入8~15化合物(IX)當量體積的乙酸乙酯,再加入化合物(XXIV)的晶體作為晶種,攪拌結晶。
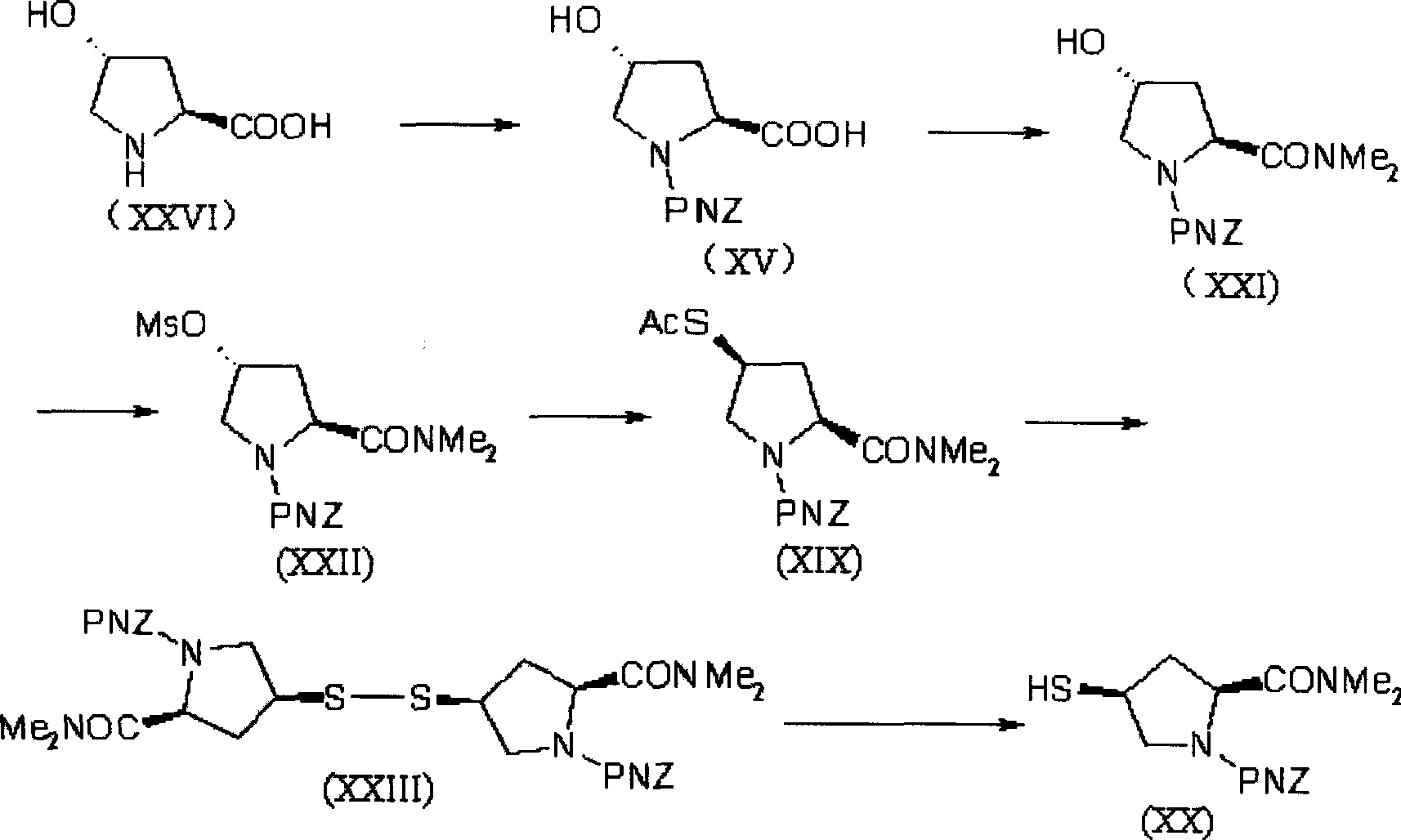
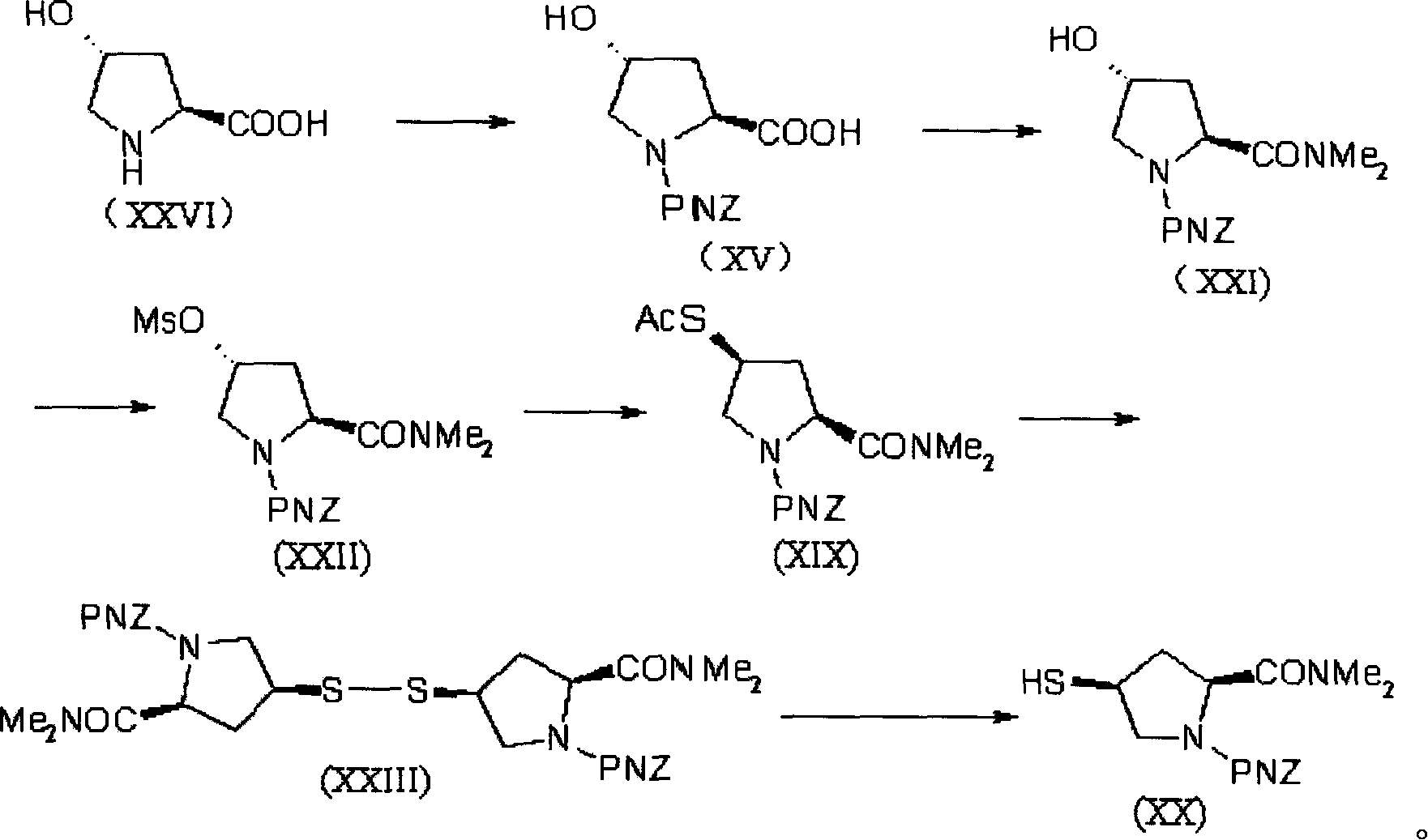
該發明中4-巰基吡咯烷衍生物(美羅培能側鏈),即化合物(XX)的合成可以用各種方法製得,優選按照以下合成路線由trans-4-羥基-L-脯氨酸製得:
1)從式(XXVI)化合物製備得到式(XV)化合物;
2)從式(XV)化合物製備得到式(XXI)化合物;
3)從式(XXI)化合物製備得到式(XXII)化合物;
4)從式(XXII)化合物製備得到式(XIX)化合物;
5)從式(XIX)化合物製備得到式(XXIII)化合物;
6)從式(XXIII)化合物製備得到式(XX)化合物;
合成路線為:
步驟1):反應可用各種已知的方法完成,通常用保護胺基酸上氨基的方法進行,例如,在鹼存在下與氯甲酸對硝基苄酯反應的方法。
步驟2):反應可用各種已知方法進行,將羧基轉換成醯胺基,例如,與氯甲酸異丙酯反應形成具有活性的衍生物,然後用二甲胺或其鹽酸鹽在有機鹼存在下反應。
步驟3),4):反應可用各種已知方法完成,將羥基轉換成有保護的硫醇基,例如,將(XXI)中的羥基轉換為活性的甲磺醯酯(XXII),然後與各種硫化合物反應,例如硫代乙酸鉀,三苯基甲硫醇等。
該步驟也可通過醇衍生物與硫化合物反應完成,反應在惰性溶劑(如四氫呋喃等)中,在三苯基膦和偶氮二甲酸二乙酯存在下進行。
步驟5):該步是硫保護基脫除與硫化物的氧化同時進行,反應生成穩定的連二硫化物晶體(XXIII)。反應在醋酸鎳的存在下,在惰性溶劑(如四氫呋喃等)中進行。
步驟6):連二硫化物晶體(XXIII)在含水的有機溶劑中,用三丁基膦還原為硫醇衍生物(XX)。
改善效果
1、在該發明中,化合物(XXIV)可由化合物(IX)一鍋煮得到;化合物(IX)可採用一鍋煮合成法由化合物(VI)製備而得;化合物(VI)可採用一鍋煮合成法從化合物(IV)製備而得。該方法可使原本需要多步反應才能實現的目的一次完成,極大地縮短了反應周期,提高了勞動生產率,減少工業化時的設備投資,減少了使用溶劑的種類和使用數量,減少了環境污染,降低了工廠的生產成本。
2、《美羅培南的製備方法》的製備方法操作簡便、產物分離容易,產品的純度和收率顯著提高。
3、在該發明中,原料簡單易得,從而節約了生產成本。
權利要求
1、《美羅培南的製備方法》包括下述步驟:
a)使式(IV)化合物與式(XV)化合物反應得到式(VI)化合物;
b)從式(VI)化合物製備得到式(IX)化合物;
c)從式(IX)化合物製備得到式(XI)化合物;
d)使式(XI)的化合物與式(XX)化合物反應,生成式(XXIV)化合物;
e)使式(XXIV)化合物在催化劑的作用下生成式(I)的美羅培南;
合成路線為:
2、權利要求1所述的製備方法,其特徵在於所述方法中,所述步驟c)獲得的式(XI)化合物不經分離直接與式(XX)化合物反應製備式(XXIV)化合物。
3、權利要求1所述的製備方法,其特徵在於使式(IV)化合物與式(XV)化合物反應後,加入甲苯到反應液中,並用4N的鹽酸洗到pH為偏酸性;然後在該溶液中加入雙氧水和氫氧化鋰進行水解,水解後先將反應物調成酸性,分出含大量雙氧水的水層;再將該水層調回到鹼性,加入亞硫酸鈉水溶液還原其餘的雙氧水;最後過濾,用有機溶劑洗去濾液中的有機物,加鹽酸析出式(VI)化合物。
4、權利要求1所述的製備方法,其特徵在於所述步驟c)中,以選自乙酸乙酯、
四氫呋喃、二氯甲烷的一種或多種的有機溶劑,其用量為式(IX)化合物的1~10倍體積;所述催化劑為
乙酸銠或
辛酸銠為催化劑,其用量為式(IX)的化合物的0.1~1%倍當量,反應溫度為25~100℃;然後,在含有機鹼的惰性溶劑中,式(X)化合物與氯代磷酸二苯酯反應生成式(XI)化合物,其中所述惰性溶劑選自二氧雜環己烷、四氫呋喃、二甲基甲醯胺、
二甲基亞碸、乙腈、
六甲基磷醯胺的一種或多種,所述有機鹼的用量為式(IX)化合物摩爾量的1~2倍,反應溫度為-15°C~0°C,所述氯代磷酸二苯酯的用量為式(IX)化合物摩爾量的1~2倍。
5、權利要求1所述的製備方法,其特徵在於所述步驟d)反應在含鹼的惰性溶劑里進行,反應溫度為-78℃~60℃,惰性溶劑為選自二氧雜環己烷、四氫呋喃、二甲基甲醯胺、二甲基亞碸、
乙腈、六甲基磷醯胺的一種或多種,鹼為有機鹼。
6、權利要求1所述的製備方法,其特徵在於所述步驟e)反應在含鹼的溶劑中進行,反應溫度為0℃~100℃,所述溶劑為有機溶劑或含水的有機溶劑;催化劑為鉑或
鈀碳,反應在大氣壓力或加壓的氫環境中進行。
7、權利要求2所述的製備方法,其特徵在於所述步驟C)中從式(IX)化合物製備得到含式(XI)化合物的反應液,該反應液或其濃縮物不經過分離直接用於製備式(XXIV)的化合物,反應在含鹼的惰性溶劑里進行,反應溫度為-78℃~60℃。
8、權利要求1所述的製備方法,其特徵在於所述式(XX)化合物的製備步驟包括:
1)從式(XXVI)化合物製備得到式(XV)化合物;
2)從式(XV)化合物製備得到式(XXI)化合物;
3)從式(XXI)化合物製備得到式(XXII)化合物;
4)從式(XXII)化合物製備得到式(XIX)化合物;
5)從式(XIX)化合物製備得到式(XXIII)化合物;
6)從式(XXIII)化合物製備得到式(XX)化合物;
合成路線為:
9、權利要求8所述的製備方法,其特徵在於所述步驟5)中,反應在含醋酸鎳的惰性溶劑中進行;所述步驟6)中,用三丁基膦將式(XXIII)的化合物還原為式(XX)的化合物,反應在含水的有機溶劑中進行。
10、權利要求1或2所述的製備方法,其特徵在於所述式(XXIV)化合物的分離方法為:用疏水性有機溶劑稀釋反應物,以選自
乙酸乙酯、二氯甲烷、二異丙醚的一種或多種為溶劑,加入pH5~6的磷酸鹽緩衝溶液洗滌有機相5~6次,然後用鹽水洗,
無水硫酸鎂乾燥,濃縮後直接用於下一步反應的原料。
11、權利要求10所述的製備方法,其特徵在於所述式(XXIV)化合物的分離方法進一步包括將獲得的式(XXIV)化合物結晶的步驟。
實施方式
實施例1
(5R,6S,8R,2’S,4’S)-p-硝基苄基-3-[4-(1-p-硝基苄氧羰基-1-二甲胺基羰基)吡咯烷基硫]-6-(1-p-硝基苄氧羰基乙氧基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸酯(XXIV)的合成
在裝有回流冷卻器的瓶中,加入40克(0.102摩爾)的重氮酮酯(IX)和200毫升的乙酸乙酯,混合物攪拌加熱到60℃,加入140毫克的辛酸銠,在相同溫度下強烈攪拌30分鐘,直到重氮酮酯(IX)反應完畢,得到1-β-甲基雙環酮酯(X)的溶液。反應液不經分離直接進入下一步。
取上述1-β-甲基雙環酮酯(X)的溶液,加入300毫升乙腈(乾品),冰鹽浴冷卻到-10~-15℃並且用氮氣保護,然後加入14.57克(0.113摩爾)的二異丙基乙胺和27.54克(0.102摩爾)的氯磷酸二苯酯。反應混合物在相同溫度下,攪拌5小時直到1-β-甲基雙環酮酯(X)反應完全,得到1-β-甲基烯磷酸酯(XI)溶液。然後,在反應混合物相同溫度下加入34克(0.096摩爾)的[2S,4S]-1-p-硝基苄氧羰基-2-二甲胺基羰基-4-巰基吡咯烷(XX)和15.4克(0.133摩爾)的二異丙基乙胺,攪拌5~8小時。反應結束後,所得反應溶液用500毫升乙酸乙酯稀釋,並用3.5%的磷酸二氫鈉水溶液洗滌5次,有機相用無水硫酸鎂乾燥,減壓蒸餾除去溶劑。殘留物為75克(HPLC定量為60克目的化合物,收率84%)可直接用於下一步反應,也可加入250毫升乙酸乙酯,加入晶種,在10~15℃下攪拌3~5小時,則有大量的晶體析出,過濾收集晶體,乾燥,得到53.4克(收率75%)的(5R,6S,8R,2’S,4’S)-p-硝基苄基-3-[4-(1-p-硝基苄氧羰基-1-二甲胺基羰基)吡咯烷基硫]-6-(1-p-硝基苄氧羰基乙氧基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸酯(XXIV)晶體。
化合物(XXIV)的物理性質測定結果:
IRmax(cm):1780,1745,1705,1650,1605,1515,1342,1257。
NMRδ(CDCl3):1.49(3H,d,J=6Hz),2.99(3H,s),3.11(3H,s),5.25(4H,s),5.23和5.46(2H,ABq,J=14Hz),7.53(4H,d,J=8.5Hz),7.62(2H,d,J=8.5Hz),8.18(6H,d,J=8.5Hz)。
[α]D+7.7°(c=0.303,丙酮)。
實施例2
(5R,6S,8R,2’S,4’S)-3-[4-(2-二甲胺基羰基)吡咯烷基硫]-6-(1-羥基乙基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸(I)的合成
將(5R,6S,8R,2’S,4’S)-p-硝基苄基-3-[4-(1-p-硝基苄氧羰基-2-二甲胺基羰基)-吡咯烷基硫]-6-(1-p-硝基苄氧羰基乙氧基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸酯(XXIV)(即上一步濃縮油狀物)15克(HPLC定量為12.5克)溶解於250毫升四氫呋喃中,攪拌下加入200毫升水。將該溶液置於1升的熱壓釜中,然後攪拌下加入5.5克的2,6-二甲基吡啶和2克的10%鈀碳。所得混合物在1.8MPa的氫氣壓下,進行氫化反應1小時。過濾除去催化劑,濾液用800毫升的丙酮稀釋,然後,在5~15℃下加入晶種,30分鐘後有大量結晶析出,再在相同溫度下滴加400毫升的
丙酮,攪拌30分鐘,過濾採集晶體,並用50毫升丙酮洗滌晶體,40℃下真空乾燥,得到5.1克(收率65%)的(5R,6S,8R,2’S,4’S)-3-[4-(2-二甲胺基羰基)吡咯烷基硫]-6-(1-羥基乙基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸(I)的三水合物,淺黃色晶體。
化合物(I)的物理性質測定結果:
UVmaxnm:297
IRmaxcm:1755,1627,1393,1252,1130。
NMRδ(D2O):1.25(3H,d,J=6.4Hz),1.81-1.96(1H,m),2.96(3H,s),3.03(3H,s),3.14-3.20(3H,m),3.31-3.41(2H,m),3.62-3.72(1H,m),3.90-4.00(1H,m),4.14-4.26(2H,m),4.63(1H,t,J=8.5Hz)。
實施例3
(5R,6S,8R,2’S,4’S)-3-[4-(2-二甲胺基羰基)吡咯烷基硫]-6-(1-羥基乙基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸(I)的合成
將(5R,6S,8R,2’S,4’S)-p-硝基苄基-3-[4-(1-p-硝基苄氧羰基-2-二甲胺基羰基)-吡咯烷基硫]-6-(1-p-硝基苄氧羰基乙氧基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸酯(XXIV)10克(結晶物)溶解於250毫升四氫呋喃中,攪拌下加入200毫升水。將該溶液置於1升的熱壓釜中,然後攪拌下加入5.5克的2,6-二甲基吡啶和2克的10%鈀碳。所得混合物在1.8MPa的氫氣壓下,進行氫化反應1小時。過濾除去催化劑,濾液用800毫升的丙酮稀釋,然後,在5~15℃下加入晶種,30分鐘後有大量結晶析出,再在相同溫度下滴加400毫升的丙酮,攪拌30分鐘,過濾採集晶體,並用50毫升丙酮洗滌晶體,40℃下真空乾燥,得到4.5克(收率71.8%)的(5R,6S,8R,2’S,4’S)-3-[4-(2-二甲胺基羰基)吡咯烷基硫]-6-(1-羥基乙基)-1-氮雜雙環[3.2.0]-庚-2-烯-7-酮-2-羧酸(I)的三水合物,淺黃色晶體。
化合物(I)的物理性質測定結果:
UVmaxnm:297
IRmaxcm:1755,1627,1393,1252,1130。
NMRδ(D2O):1.25(3H,d,J=6.4Hz),1.81-1.96(1H,m),2.96(3H,s),3.03(3H,s),3.14-3.20(3H,m),3.31-3.41(2H,m),3.62-3.72(1H,m),3.90-4.00(1H,m),4.14-4.26(2H,m),4.63(1H,t,J=8.5Hz)。
實施例4
(3S,4R)-3-[(1R)-1-羥乙基]-4-[(1R)-1-甲基-3-重氮-3-PNB氧羰基-2-酮基丙基]-雜氮環丁-2-酮(IX)的合成
將25克(86毫摩爾)的雜氮環丁酮羧酸(VI)加入到300毫升的無水乙腈中,攪拌下加入17.5克(110毫摩爾)的羰基二咪唑混合物在室溫下攪拌30分鐘,然後加入55.5克(110毫摩爾)的無水丙二酸單對硝基苄酯鎂鹽,反應混合物在25~35℃攪拌18小時。反應結束後,在攪拌下反應混合物中加入450毫升的乙酸乙酯和450毫升的1N的鹽酸,使水相pH在2~3,有機相分別用鹽水、5%的碳酸鉀水溶液、鹽水徹底洗滌,得到(3S,4R)-3-[(1R)-1-叔丁基二甲基矽氧乙基]-4-[(1R)-1-甲基-3-PNB氧羰基-2-酮基丙基]-雜氮環丁-2-酮(VII)的乙酸乙酯溶液,不經分離可進行下一步。
在上述O-叔丁二甲基矽基酮酸酯(VII)的乙酸乙酯溶液加入100毫升的甲醇,然後在20~25℃加入100毫升的6N鹽酸,反應混合物在相同溫度下攪拌2小時,反應結束後加入500毫升的飽和鹽水,有機相再用2×500毫升的10%的磷酸氫二鈉洗滌,然後飽和鹽水洗滌,無水硫酸鎂乾燥,真空濃縮,濃縮物主要為(3S,4R)-3-[(1R)-1-羥乙基]-4-[(1R)-1-甲基-3-PNB氧羰基-2-酮基丙基]-雜氮環丁-2-酮(VIII)。不經分離可進行下一步。
上述濃縮物加入140毫升的乙腈,攪拌溶解後,在0~5℃加入30.3克(86毫摩爾)的對十二烷基苯磺醯疊氮和9.6克(95毫摩爾)的三乙胺,反應混合物攪拌2小時,加入0.5N的鹽酸220毫升攪拌洗滌,有機相徹底的用水、鹽水洗滌,無水硫酸鎂乾燥,真空濃縮,得到的油狀物用250毫升的矽膠進行柱層析(洗脫液為乙酸乙酯-石油醚=2∶1(V/V))得到淡黃色晶體25克(收率77.2%)為(3S,4R)-3-[(1R)-1-羥乙基]-4-[(1R)-1-甲基-3-重氮-3-PNB氧羰基-2-酮基丙基]-雜氮環丁-2-酮(IX)。
化合物(IX)的物理性質測定結果:
[α]D=-50.4°(c=2.5,CH2Cl2)
IRmaxcm:2140,1750,1q720,1650。
NMRδ(CDCl3):1.22(3H,d,J=6.0Hz),1.32(3H,d,J=6.0Hz),2.38(1H,d,J=3.2Hz),2.92(1H,dd,J=2.4,7.6Hz),3.77(1H,m),3.86(1H,m),4.15(1H,m),5.38(2H,s).5.90(1H,s),7.57and8.30(2H,m)。
實施例5
(3S,4R)-3-[(1R)-1-叔丁基二甲基矽氧乙基]-4-[(1R)-1-甲基-1-羧乙基]-雜氮環丁-2-酮(VI)的合成
將34克(0.523)的鋅粉加入60毫升的無水四氫呋喃中,攪拌下加熱至沸,然後加入50克(0.174摩爾)(3S,4R)-4-乙醯氧基-3-[(1R)-1-叔丁基二甲基矽氧乙基]雜氮環丁-2-酮(IV)和90克(0.256摩爾)3-(2-溴丙基)-螺[2,3-二氫-4H-1,3-苯並惡嗪-2,1’-環己基]-4-酮(XV)溶於180毫升的無水四氫呋喃形成的混合溶液,加入速度以反應液不爆沸為宜,加完後回流30分鐘,降溫至室溫,反應混合物中加入5克硅藻土,反應混合物抽濾,濾渣用適量的四氫呋喃洗滌,合併濾液和洗液,加入60毫升的
甲苯,在該混合物中加入200毫升的2N鹽酸,調節pH為5~6,有機相用鹽水洗滌兩次。即為3-{(2R)-2-[(3S,4R)-3-[(1R)-1-叔丁基二甲基矽氧乙基]-2-酮基雜氮環丁-4-基]丙基}-螺[2,3-二氫-4H-1,3-苯並惡嗪-2,1’-環己基]-4-酮(XIV)的四氫呋喃-甲苯溶液。該混合物不經分離進入下一步。
上述反應混合物中加入150毫升的四氫呋喃,溫度控制在5~15℃,攪拌下加入96克30%的雙氧水,再加入21克的一水氫氧化鋰,在相同溫度下攪拌反應3小時。反應結束後,反應混合物在攪拌下加入130毫升左右的4N鹽酸調節pH為2,有機相用鹽水洗滌3次。有機相在5~15℃攪拌下加入200毫升左右6%的氫氧化鈉調節pH為10,然後加入50毫升左右的17%亞硫酸鈉至溶液澱粉KI試紙不變色。抽濾,濾渣用水洗3~4次,合併濾液和洗液。水相再用乙酸乙酯洗3~4次,真空抽乾淨水相中的乙酸乙酯,然後反應混合物在5~15℃攪拌下加入4N鹽酸調節pH為2,有大量結晶析出,在相同溫度下攪拌2小時,過濾,用水洗滌晶體,乾燥,得到46克(收率87.7%)的(3S,4R)-3-[(1R)-1-叔丁基二甲基矽氧乙基]-4-[(1R)-1-甲基-1-羧乙基]-雜氮環丁-2-酮(VI)白色結晶。
化合物(VI)的物理性質測定結果:
Mp:146~147℃
IRmax(cm):1740,1465,1330,1255,1043,837。
NMR:0.08(6H,s),0.7(9H,s),1.24(3H,d,J=7),1.30(3H,d,J=7.5),2.78(1H,m),3.06(1H,m),3.98(1H,m),4.24(1H,m),6.37(1H,寬)。
實施例6
(2S,4R)-2-二甲胺羰基-4-乙醯硫基-1-PNZ-吡咯烷(XIV)的合成
1、反式-1-(p-硝基苄氧羰基)-4-羥基-L-脯氨酸(XV)的合成
將26.2克(0.20摩爾)的L-羥脯氨酸(XXIV)在攪拌下加入到220毫升2N氫氧化鈉溶液中,降溫0~5℃,滴加47.3克(0.22摩爾)的氯甲酸對硝基苄酯溶解在40毫升的二氯甲烷中的溶液,在相同溫度下攪拌1小時,然後分出二氯甲烷相,水相再用70毫升的二氯甲烷洗滌,水相用36.6克的濃硫酸在0~5℃酸化,有大量的結晶析出,抽濾收集結晶,並用水洗,乾燥,得到57.8克化合物(XV)(收率93%),熔點:134~135.5℃。
2、(2S,4R)-2-二甲胺羰基-4-羥基-1-PNZ-吡咯烷(XVI)的合成
將31.0克(0.1摩爾)的化合物(XV)加入到150毫升的二氯甲烷中,攪拌下加入15.2克(0.15摩爾)的三乙胺。在-10~0℃,滴加18.4克(0.15摩爾)的氯甲酸異丙酯,混合物在相同溫度下攪拌1小時,然後加入16.3克(0.20摩爾)的鹽酸二甲胺,在-10~0℃,滴加30.3克(0.30摩爾)的三乙胺,加完後,攪拌1小時。反應混合物徹底地用1N鹽酸,鹽水,5%的碳酸氫鈉,鹽水洗,無水硫酸鎂乾燥,過濾濾去乾燥劑,得到(2S,4R)-2-二甲胺羰基-4-羥基-1-PNZ-吡咯烷(XVI)的二氯甲烷溶液,不經分離進入下一步。
3、(2S,4R)-2-二甲胺羰基-4-甲磺醯氧基-1-PNZ-吡咯烷(XVII)的合成
在上步得到化合物(XXI)的二氯甲烷溶液中加入21.8克(0.24摩爾)的三乙胺,在-10~0℃,滴加16.8克(0.15摩爾)的甲磺醯氯,然後混合物在相同溫度下攪拌1小時。反應混合物徹底地用鹽水,5%的碳酸氫鈉,鹽水洗,無水硫酸鎂乾燥,過濾濾去乾燥劑,真空除去溶劑,濃縮物用甲醇-石油醚(2∶1,v/v)重結晶,得到29.8克化合物(XVII)(收率73%)白色晶體,熔點:115~116℃。
4、(2S,4R)-2-二甲胺羰基-4-乙醯硫基-1-PNZ-吡咯烷(XIX)的合成
將20.8克(0.05摩爾)的化合物(22)和8.55克(0.075摩爾)的硫代乙酸鉀加入到60毫升DMF和60毫升甲苯的混合溶劑中,在65~70℃攪拌反應6小時。然後冷卻,反應混合物用300毫升甲苯和200毫升水稀釋,水相再用100毫升的甲苯萃取,合併有機相,用鹽水洗後無水硫酸鎂乾燥,過濾除去乾燥劑,真空除去溶劑,濃縮物不經分離進行下一步。
實施例7
(2S,4R)-2-二甲胺羰基-4-巰基-1-PNZ-吡咯烷(XX)的合成
在實施例5的第4步驟中(2S,4R)-2-二甲胺羰基-4-乙醯硫基-1-PNZ-吡咯烷(XIX)濃縮物中加入200毫升的四氫呋喃,加入15克(60毫摩爾)四水醋酸鎳,攪拌並加熱回流2小時,反應完全後降溫,加入甲苯100毫升,然後用水,鹽水洗滌,有機相無水硫酸鎂乾燥,真空蒸餾除去溶劑,再加入150毫升甲醇,攪拌冷卻到10℃左右,則有大量沉澱物,過濾,乾燥,得15克(收率為85%)到雙[(2S,4R)-2-二甲胺羰基-1-PNZ-吡咯烷-4-基]二硫化物(XXIII)淺黃色粉末。
MS:M+1=705
IR:cm1705,1650,1515
HNMR(CDCl3):1.90(1H,d),2.97(3H,s),3.08(3H,s),5.19(2H,s),7.48(2H,d),8.15(2H,d)。
將15克(21毫摩爾)雙[(2S,4R)-2-二甲胺羰基-1-PNZ-吡咯烷-4-基]二硫化物(XXIII)懸浮在80毫升四氫呋喃和80毫升水的混合溶劑中,在氮氣保護及攪拌下滴加6克(60毫摩爾)的正三丁基膦,攪拌30分鐘反應完全後,加入100毫升乙酸乙酯和200毫升水,攪拌洗滌後,有機相用無水硫酸鎂乾燥,真空蒸餾除去溶劑,濃縮物加入100毫升乙酸乙酯,攪拌結晶,待有大量結晶後滴加50毫升的石油醚,過濾收集晶體,乾燥,得到13.5克(收率90%)的(2S,4R)-2-二甲胺羰基-4-巰基-1-PNZ-吡咯烷(XX)淡黃色結晶。
化合物(XX)的物理性質測定結果:
Mp:118.5~119.5℃
[α]D=+9.60°(c=1.0,CHCl3)
MS:M+1=354
IR:cm1705,1650,1515
HNMR(CDCl3):1.90(1H,d),2.97(3H,s),3.08(3H,s),5.19(2H,s),7.48(2H,d),8.15(2H,d)。
榮譽表彰
2014年11月6日,《美羅培南的製備方法》獲得第十六屆中國專利優秀獎。