對應的氧化物中正離子能單獨形成玻璃的離子稱為網狀形成離子,該物質稱為網狀形成劑,其中氧化物的單鍵強度大於335kJ/mol。
基本介紹
- 中文名:網狀形成離子
- 外文名:Reticulate ion
- 釋義:能單獨形成玻璃的離子
- 學科:陶瓷材料學
簡介,特點,對比,判斷依據,舉例,
簡介
摻入的電離雜質,按其在二氧化矽網路中的位置和作用,可以分為兩類:網狀形成離子和網狀調節離子。有少數雜質(如鋁)兩種作用都具備。在矽-氧四面體中可以取代矽原子並形成網路的一種雜質,稱為網狀形成離子,又稱為替位式雜質。
特點
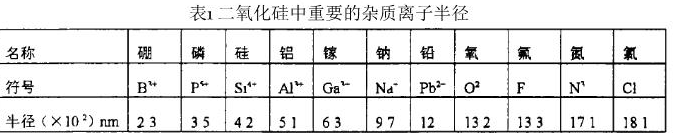
常見的網狀形成離子有硼、磷、銻等正離子,它們的特點是離子半徑與Si原子的半徑相近或更小,單鍵強度大於335kJ/mol。
 網路形成離子
網路形成離子對比
網狀改成離子:網狀變性體中的正離子稱為網狀改成離子,其單鍵強度<250 kJ/mol,這類氧化物不能形成玻璃,但能改變網路結構,從而使玻璃性質改變。
判斷依據
玻璃形成能力不僅與單鍵能有關,還與破壞原有鍵使之析晶所需的熱能有關,用單鍵能除以熔點的比值來作為衡量玻璃形成能力的參數。單鍵能愈高,熔點愈低的氧化物愈易形成玻璃。凡氧化物的單鍵能/熔點大於0.42kJ·(mol·K)-1者稱為網狀形成離子;單鍵能/熔點小於0.125kJ·(mol·K)-1者稱為網狀改成離子;數值介於兩者之間者稱為網狀中間離子。
此判據使網路形成體與網路變性體之間的差別更為懸殊地反映出來。用此判據解釋B2O3易形成穩定的玻璃而難以析晶的原因,是由於B2O3的單鍵能/熔點比值在所有氧化物中最大的緣故。此判據有助於理解在一元或多元系統中當組成落在低共熔點或共熔界線附近時,易形成玻璃的原因
舉例
在二氧化矽網路中,矽的化合價是4,配位數為(中心離子周圍配位原子的數目) 4,而網狀形成離子的化合價與矽不同,配位數也不一樣。當它們替代矽原子的位置後,其配位數也發生變化。
例如硼(B3+) 在B2O3中配位數為3,替代矽原子後B的配位數將由3變為4,結果造成二氧化矽中缺氧狀態,使網路中非橋鍵氧離子濃度減少,二氧化矽膜的強度增大。
磷(P5+) 摻入後,其配位數由5變為4,結果造成二氧化矽中剩氧狀態,使網路中非橋鍵氧離子濃度增大,二氧化矽膜的強度減弱。