基本介紹
- 中文名:細胞同步化
- 外文名:Cell synchronization
- 方法1:振盪收集法
- 方法2:秋水仙胺阻抑法
- 方法3:盪收集細胞
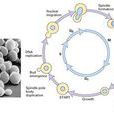
M期同步化,S期同步化,G1期和G2期,G0期,檢測,結合使用,
M期同步化
(一)M期同步化方法
1.振盪收集法
2.秋水仙胺阻抑法
(1)將細胞傳代培養至指數生長期。
(2)加入秋水仙胺,使最終濃度為0.05—0.1μg/mL培養基,作用6—7 h。如使用秋水仙素,使用濃度應加大5~10倍。
(3)盪收集細胞,800 r/min離心5—10 min,棄上清,收集的沉澱細胞即為M期細胞。 加入一定量培養基將細胞接種到培養瓶中或直接進行離體實驗。由於秋水仙素或秋水仙胺對細胞有一定毒性,用量較小或作用時間較短細胞活性尚可恢復,而用量過大或時間過長則細胞不能存活,因此使用時應嚴格控制其劑量和作用時間。
3.N2阻斷法 此方法較秋水仙胺阻抑法好。
(1)將細胞傳代培養至指數生長期。
(2)將培養瓶置於N20罐中通人適量CO2(約相當於罐中體積的5%)。
(3)關閉好N2罐,接上N2管子及壓力表,緩緩向罐中充氣一直到壓力為80-90磅/英寸2為止。
(4)將N2裝置放在37℃培養箱中10—16 h(通常過夜)。次日從培養箱中取出,然後緩緩將N2放出(最好放出窗外)。
(5)取出細胞在鏡下觀察同步化效果,用振盪法收集細胞於離心管中。
(6)800 r/min離心10 min收集細胞。
S期同步化
(二)S期同步化方法
胸腺嘧啶核苷(TdR)雙阻斷法:該法利用過量TdR能阻礙DNA合成的原理而設計,為了加強細胞同步化效果,常採用兩次TdR阻斷法,即雙阻斷法。第1次阻斷時間相當於G2、M和G1期時間的總和或稍長,釋放時間不短於S期時間,而小於G2+M+G1期時間,這樣才能使所有位於G1/S期的細胞通過S期,而又不使沿周期前進最快的細胞進入下一個S期。第2次阻斷時間同第1次,再釋放。現以HeLa細胞為例加以說明(HeLa細胞周期時間為21 h,其中G1期為10 h,S期為7 h,G2期為3 h,M期為1 h)。
1.將細胞培養至指數生長期的早期。
2.加入含2 mmol/L TdR的培養基(2—2.5 mmol/L用於腫瘤細胞的同步化培養,而CHO細胞則用7 mmol/L TdR),作用16 h。
3.棄掉TdR培養基,用Hanks液洗2—3次,再換上新鮮培養基繼續溫浴9 h。
4.重新加入TdR培養基(濃度同上)進行第2次阻斷,作用16 h。
5.再棄掉TdR培養基,Hanks液洗2—3次後換上普通培養基。第2次TdR釋放0 h時取樣則細胞處於G1/S期交界處;如2-7 h取樣則為不同階段的S期細胞。 注意:具體TdR作用和釋放的時間應參考每一種待同步化細胞的細胞周期各時相測定的參考值,也可根據經驗確定。
G1期和G2期
(三)G1期和G2期細胞的獲得
1.G2期細胞的獲得 根據細胞周期測定的數值,採用TdR雙阻斷法使細胞同步在G1/S期交界處後,洗去TdR使細胞釋放後繼續培養。其培養時間應大於S期時間而小於S+G2期時間。然後先用振盪法使已進入M期的細胞脫落,棄去上清培養基;再用胰酶消化,加入新鮮培養基製成細胞懸液,離心收集細胞,即為G2期細胞。
2.G1期細胞的獲得
(1)將用M期阻斷法獲得的細胞加入一定量的培養基,繼續培養1-10 h即可獲得各階段的G1期細胞。
(2)用缺乏異亮氨酸的培養基培養細胞,培養時間超過一個細胞周期,即可獲得中G1期細胞。
G0期
(四)G0期細胞的獲得
可採用血清飢餓法得到G0期細胞:
1.取處於對數生長期的細胞。
2.用含0.5% - 1%小牛血清的培養基培養細胞48-72 h。或用無血清的培養基培養24 h。
3.用0.1% - 0.25%胰蛋白酶消化細胞可收穫G0期細胞,可用’H-TdR摻人進行測量鑑定。
檢測
(五)同步化細胞的檢測 對各個時期的同步化細胞可通過流式細胞術來鑑定其細胞周期,通過比較各時相細胞的百分比,看是否達到預期的目的。S期細胞可通過放射自顯影來鑑定結果(圖2—3—2),M期細胞可塗片、染色,在顯微鏡下觀察染色體,計有絲分裂指數(圖2—3—3)。
圖2—3—2放射自顯影顯示S期同步化後的HeLa細胞, 觀察細胞核內’H—TdR的摻入(彭安,1993)
圖2—3—3秋水仙胺M期同步化後的HeLa細胞,顯示細胞分裂相(彭安)
 圖2—3—3
圖2—3—3 圖2—3—2
圖2—3—2