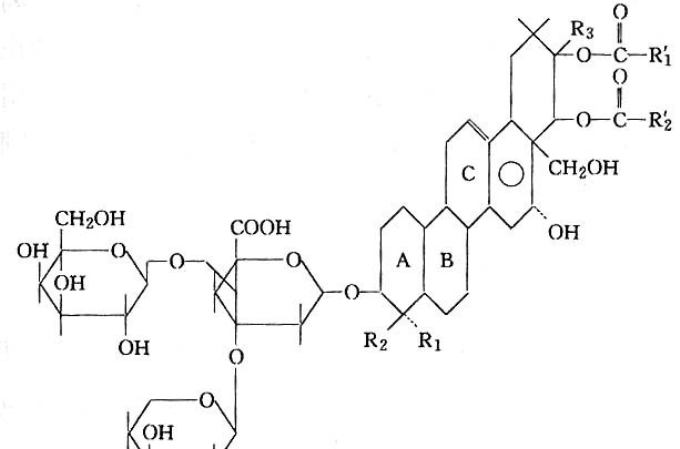
糖苷酶轉化人參皂苷的研究是指東北師範大學對一些稀有人參皂苷的合成中糖苷酶介導的生物轉化法的研究探討。
本課題重點探討了如何尋找活性高、專一性好的糖苷酶,用以轉化大量皂苷從而製備稀有皂苷的方法。
該論文的主要研究成果如下:
研究了12種商品糖類水解酶對人參二醇型皂苷混合物和單體皂苷Rb1的水解。
從人參種植土壤中篩選到一株真菌sp.68,該菌能高效轉化人參二醇型皂苷混合物,產生一系列稀有人參皂苷產物,其終產物為人參皂苷C-K
對草酸青黴產生的發酵液進行分離純化,經過一系列色譜層析分離純化後,得到三個純的胞外糖苷酶GH1、GH3-1和GH3-2。對這三種酶的酶學性質進行研究
基本介紹
- 中文名:糖苷酶轉化人參皂苷的研究
- 授予單位:東北師範大學
- 學位級別:博士
- 分類號:S567.51
相關信息,內容摘要,論文目錄,
相關信息
【關鍵字】:生物轉化人參皂苷草酸青黴糞肥桿菌糖苷水解酶
【學位授予單位】:東北師範大學
【學位級別】:博士
【學位授予年份】:2012
【分類號】:S567.51
【學位授予單位】:東北師範大學
【學位級別】:博士
【學位授予年份】:2012
【分類號】:S567.51
內容摘要
人參皂苷是人參的主要活性成分之一,目前已從人參中分離純化出約四十種人參皂苷。研究表明,不同的皂苷活性不同,一些稀有人參皂苷,具有顯著的藥理學活性,如人參皂苷C-K,具有抗腫瘤、抗炎症、抗衰老等活性。而這些稀有皂苷在天然人參中含量甚微,只能通過人工方法製備。因此,製備稀有人參皂苷成為目前研究的熱點。由於稀有皂苷與某些高含量人參皂苷相比,其皂苷母環結構相同,只是糖基數目不同。因此,理論上可以通過水解大量皂苷的糖基來製備稀有皂苷。 水解人參皂苷的糖基的主要方法有酸水解、鹼水解、加熱、糖苷酶催化等。加熱或酸、鹼水解等化學法條件劇烈,易產生副產物。糖苷酶介導的生物轉化法由於條件溫和、專一性高,是潛在的轉化方法,也是目前研究的熱點之一。通過生物轉化製備糖苷化合物或寡糖等,具有重要的理論和套用意義。因此,尋找活性高、專一性好的糖苷酶,用以轉化大量皂苷從而製備稀有皂苷,是本課題的研究重點之一。
該論文的主要研究成果如下:
1.研究了12種商品糖類水解酶對人參二醇型皂苷混合物和單體皂苷Rb1的水解。其中1種酶不轉化人參二醇型皂苷,其餘11種酶均能不同程度地轉化人參二醇型皂苷混合物和單體皂苷Rb1,但水解終產物與速率不同。8種酶水解人參皂苷Rb1產生唯一產物Rd,水解路徑為:Rb1→Rd;1種酶水解Rb1至F2,水解路徑為:Rb1→Rd→F2;2種酶水解Rb1至終產物Compound K(C-K),水解路徑分別為Rb1→Rd→F2→C-K;Rb1→Rd/GXVII→F2→C-K。此外,測試了這11種酶轉化Rb1的效率。
2.從人參種植土壤中篩選到一株真菌sp.68,該菌能高效轉化人參二醇型皂苷混合物,產生一系列稀有人參皂苷產物,其終產物為人參皂苷C-K。該菌株用分子生物學方法鑑定為草酸青黴。對草酸青黴轉化人參二醇型皂苷的能力進行了研究。首先,草酸青黴發酵液經過濾、離心後的上清經DEAE-纖維素柱層析和30-90%硫酸銨沉澱後,得到草酸青黴胞外酶液。用該酶液轉化人參二醇型皂苷Rb1、Rb2、Rc,得到如下轉化路徑:Rb1→Rd→F2→C-K;Rb2→CO→CY→C-K;Rc→Mb→Mc→C-K。對各轉化產物用TLC、HPLC和~(13)C-NMR進行了鑑定。此外,對草酸青黴胞外酶液轉化人參皂苷製備稀有皂苷C-K的條件進行了最佳化,得到如下最佳化結果:底物,Rb1;反應pH,3.5;反應溫度,55℃;底物濃度,0.5mg/ml。
3.對草酸青黴產生的發酵液進行分離純化,經過一系列色譜層析分離純化後,得到三個純的胞外糖苷酶GH1、GH3-1和GH3-2。對這三種酶的酶學性質進行研究。底物專一性結果表明:以人參皂苷作為底物時,GH1隻水解人參皂苷Rb1至唯一產物Rd,而不水解Rb2和Rc。GH3-1和GH3-2對人參皂苷Rb1、Rb2和Rc均能水解,轉化路徑為:Rb1→Rd→F2→C-K;Rb2→CO→CY→C-K;Rc→Mb→Mc→C-K。此外,對這三種酶的分子量、等電點、最適pH及pH穩定性、最適溫度及溫度穩定性等進行了研究。這三種酶雖然由同一種菌分泌到胞外,但行使不同的功能。這些糖苷酶對於人參皂苷的轉化尤其是一系列中間代謝產物的製備具有重要的套用意義。
4.從革蘭氏陽性菌——糞肥桿菌中克隆、表達並純化了七個糖苷水解酶。其中,cfi-01、cfi-08、cfi-11和cfi-13屬於糖苷水解酶家族3;cfi-02屬於糖苷水解酶家族31;cfi-04屬於糖苷水解酶家族42;cfi-10屬於糖苷水解酶家族1。對各糖苷水解酶的底物專一性進行了系統研究。在家族3的糖苷水解酶中,cfi-01是雙功能酶,同時具有β-D-木糖苷酶/-L-呋喃阿拉伯糖苷酶的活性;cfi-08和cfi-11是β-D-葡萄糖苷酶;cfi-13隻水解pNP-人工糖苷,而不水解二糖、寡糖,因此屬於芳香基-β-D-糖苷酶。家族31的cfi-02是-木糖苷酶。家族42的cfi-04是β-D-半乳糖苷酶,同時也表現出微弱的β-D-果糖苷酶活性。家族1的cfi-10活性廣泛,同時具有β-D-半乳糖苷酶、β-D-葡萄糖苷酶、β-D-果糖苷酶和β-D-木糖苷酶活性。此外,對克隆表達得到的7個糖苷水解酶轉化人參皂苷的能力進行了研究。結果表明,cfi-08和cfi-10可水解人參皂苷Rb1,產生唯一產物Rd。其它5種糖苷水解酶不能轉化人參皂苷。對草酸青黴中純化得到的三個糖苷水解酶和糞肥桿菌中克隆表達得到的七個糖苷水解酶在底物專一性方面進行了系統的比較。這些糖苷水解酶可被套用於糖苷化合物的轉化。
論文目錄
- 摘要4-6
- Abstract6-8
- 中英文對照及英文縮寫詞表8-9
- 目錄9-13
- 第一章 前言13-29
- 1.1 人參皂苷的研究進展13-21
- 1.1.1 人參皂苷的結構和分類13-16
- 1.1.2 人參皂苷的理化性質16
- 1.1.3 人參皂苷的分析16-19
- 1.1.4 人參皂苷的藥理學活性19-21
- 1.2 人參皂苷的生物轉化21-23
- 1.3 研究目標及研究意義23-25
- 1.3.1 立題依據和背景23-24
- 1.3.2 研究目標24
- 1.3.3 研究意義24-25
- 參考文獻25-29
- 第二章 12 種商品糖苷酶對人參皂苷 Rb1 的轉化29-48
- 2.1 材料、試劑和儀器29-30
- 2.1.1 試驗材料29-30
- 2.1.2 實驗試劑30
- 2.1.3 主要儀器設備30
- 2.2 實驗方法30-32
- 2.2.1 分析方法30-31
- 2.2.2 人參二醇型皂苷混合物及各單體皂苷的製備31-32
- 2.2.3 十二種商品糖苷水解酶的酶活測定32
- 2.2.4 十二種商品水解酶對人參二醇型皂苷混合物及 Rb1 的轉化32
- 2.2.5 轉化產物的分析與鑑定32
- 2.3 實驗結果分析與討論32-45
- 2.3.1 人參二醇型皂苷混合物和各單體皂苷的製備與分析32-35
- 2.3.2 十二種商品糖類水解酶對人參二醇型皂苷混合物及 Rb1 單體的轉化35-41
- 2.3.3 十二種商品糖類水解酶的酶活測定及對 Rb1 的水解效率研究41-42
- 2.3.4 轉化產物的鑑定42-45
- 2.4 討論45-46
- 2.5 總結46-47
- 參考文獻47-48
- 第三章 草酸青黴對人參二醇型皂苷轉化的研究48-66
- 3.1 材料、試劑與儀器48
- 3.1.1 試驗材料48
- 3.1.2 試劑和儀器48
- 3.2 實驗方法48-51
- 3.2.1 培養基與溶液的配製48-49
- 3.2.2 人參皂苷水解菌種的篩選49
- 3.2.3 菌種 sp.68 的鑑定49-50
- 3.2.4 菌種 sp.68 轉化人參二醇型皂苷混合物的研究50
- 3.2.5 菌種 sp.68 的胞外酶的製備50
- 3.2.6 菌種 sp.68 的胞外糖苷酶用於轉化人參皂苷50-51
- 3.2.7 菌種 sp.68 轉化人參皂苷的產物製備與鑑定51
- 3.2.8 菌種 sp.68 的胞外糖苷酶轉化人參皂苷製備 C-K 的最佳化51
- 3.3 結果分析51-62
- 3.3.1 人參皂苷轉化菌株的篩選51-52
- 3.3.2 菌種 sp.68 的分子生物學鑑定52-53
- 3.3.3 草酸青黴胞外糖苷酶的部分純化53-54
- 3.3.4 草酸青黴胞外酶液轉化人參二醇型皂苷混合物54
- 3.3.5 草酸青黴胞外酶液對各單體人參皂苷的轉化54-55
- 3.3.6 草酸青黴胞外酶液轉化人參單體皂苷的產物製備與鑑定55-61
- 3.3.7 草酸青黴胞外酶轉化人參皂苷製備 C-K 的條件最佳化61-62
- 3.4 討論62-64
- 3.5 結論64-65
- 參考文獻65-66
- 第四章 草酸青黴胞外糖苷酶的分離純化66-83
- 4.1 材料、試劑與儀器66
- 4.1.1 實驗材料66
- 4.1.2 試劑與儀器66
- 4.2 實驗方法66-69
- 4.2.1 試劑配製66-67
- 4.2.2 草酸青黴的活化及培養67
- 4.2.3 草酸青黴的胞外糖苷酶的分離純化67-68
- 4.2.4 GH1 的分離純化68
- 4.2.5 GH3 的分離純化68-69
- 4.2.6 純化過程監測69
- 4.2.7 GH1、GH3-1 和 GH3-2 的純度檢測69
- 4.3 實驗結果69-80
- 4.3.1 草酸青黴中胞外糖苷酶的初步純化69-72
- 4.3.2 GH1 的分離純化72-75
- 4.3.3 GH3 的純化75-80
- 4.4 討論80-81
- 4.5 結論81-82
- 參考文獻82-83
- 第五章 草酸青黴胞外糖苷酶的性質研究83-99
- 5.1 引言83-84
- 5.1.1 β -葡萄糖苷酶的分類83
- 5.1.2 β -葡萄糖苷酶的活性中心及催化反應的模型83-84
- 5.1.3 β -葡萄糖苷酶的分子特徵84
- 5.2 材料、試劑與儀器84
- 5.3 實驗方法84-87
- 5.3.1 GH1、GH3-1 和 GH3-2 的分子量測定84-85
- 5.3.2 GH1、GH3-1 和 GH3-2 等電點的測定85
- 5.3.3 糖蛋白檢測85
- 5.3.4 最適 pH 測定85-86
- 5.3.5 GH1、GH3-1 和 GH3-2 的 pH 穩定性86
- 5.3.6 GH1、GH3-1 和 GH3-2 的最適反應溫度86
- 5.3.7 GH1、GH3-1 和 GH3-2 的溫度穩定性86
- 5.3.8 金屬離子和抑制劑對 GH1、GH3-1 和 GH3-2 酶活性的影響86
- 5.3.9 GH1、GH3-1 和 GH3-2 動力學參數的測定86-87
- 5.3.10 GH1、GH3-1 和 GH3-2 的底物專一性測定87
- 5.3.11 GH1、GH3-1 和 GH3-2 對人參皂苷水解的時間過程87
- 5.3.12 人參皂苷水解產物的分離和鑑定87
- 5.4 結果分析與討論87-95
- 5.4.1 GH1、GH3-1 和 GH3-2 的分子量分析87-88
- 5.4.2 GH1、GH3-1 和 GH3-2 的等電點測定88-89
- 5.4.3 GH1、GH3-1 和 GH3-2 的糖蛋白檢測89-90
- 5.4.4 GH1、GH3-1 和 GH3-2 的最適 pH 和 pH 穩定性90
- 5.4.5 GH1、GH3-1 和 GH3-2 的最適溫度和溫度穩定性90-91
- 5.4.6 金屬離子和抑制劑對 GH1、GH3-1 和 GH3-2 酶活的影響91-92
- 5.4.7 GH1、GH3-1 和 GH3-2 的底物專一性分析92-93
- 5.4.8 GH1、GH3-1 和 GH3-2 的動力學常數測定93-94
- 5.4.9 GH1 對人參皂苷的轉化及轉化產物鑑定94
- 5.4.10 GH3-1 和 GH3-2 對人參二醇型皂苷的水解94-95
- 5.5 討論95-96
- 5.6 結論96-98
- 參考文獻98-99
- 第六章 糞肥桿菌中糖苷水解酶的克隆、表達、純化與性質研究99-145
- 6.1 引言99-101
- 6.1.1 糖苷水解酶家族 199-100
- 6.1.2 糖苷水解酶家族 3100
- 6.1.3 糖苷水解酶家族 31100
- 6.1.4 糖苷水解酶家族 42100-101
- 6.1.5 糞肥桿菌中糖苷水解酶的研究101
- 6.2 材料、試劑與儀器101-102
- 6.2.1 實驗材料101
- 6.2.2 主要生化試劑101-102
- 6.2.3 實驗儀器102
- 6.3 實驗方法102-111
- 6.3.1 培養基的配製102-103
- 6.3.2 大腸桿菌 AD202 感受態細胞的製備103
- 6.3.3 質粒 pCW 的提取103
- 6.3.4 糞肥桿菌中糖苷水解酶的克隆103-107
- 6.3.5 C.fimi 中糖苷水解酶的表達107
- 6.3.6 細胞破碎及目的蛋白的提取107
- 6.3.7 Western blot 檢測各重組蛋白的 His6-tag107-108
- 6.3.8 目的蛋白的純化108-109
- 6.3.9 純化過程目的蛋白的檢測109
- 6.3.10 重組糖苷酶對 pNP 底物的水解109
- 6.3.11 重組糖苷酶對人參皂苷的水解109-110
- 6.3.12 糖苷酶對不同二糖和寡糖的水解110
- 6.3.13 各重組酶的最適 pH 測定110-111
- 6.3.14 各重組酶的最適溫度測定111
- 6.3.15 各重組酶的動力學參數研究111
- 6.4 結果分析與討論111-139
- 6.4.1 糞肥桿菌中糖苷酶的克隆111
- 6.4.2 目的基因的 PCR 擴增111-112
- 6.4.3 酶切、連線及轉化112
- 6.4.4 重組質粒鑑定112
- 6.4.5 家族 3 的糖苷酶的表達、純化與性質研究112-118
- 6.4.6 家族 3 的糖苷水解酶對 pNP-人工糖苷的水解118-119
- 6.4.7 家族 3 的糖苷水解酶對二糖、寡糖的水解119-126
- 6.4.8 家族 3 的糖苷水解酶對 pNP 底物的動力學常數126
- 6.4.9 家族 3 的糖苷水解酶的最適 pH 和最適溫度研究126-127
- 6.4.10 家族 1 的糖苷酶 cfi-10 的表達、純化與性質研究127-132
- 6.4.11 家族 31 的糖苷水解酶 cfi-02 的表達、純化與性質研究132-134
- 6.4.12 家族 42 的糖苷水解酶 cfi-04 的表達、純化和性質研究134-137
- 6.4.13 糞肥桿菌中糖苷水解酶對人參皂苷的轉化137-138
- 6.4.14 草酸青黴和糞肥桿菌中糖苷水解酶的比較138-139
- 6.5 討論139-142
- 6.6 結論142-143
- 參考文獻143-145
- 論文總結145-147
- 附錄147-153
- 致謝153-154