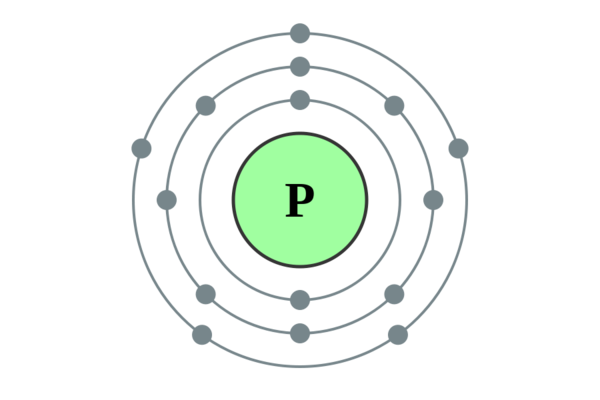
磷(化學元素)
本詞條是多義詞,共2個義項
更多義項 ▼
收起列表 ▲
磷(Phosphorus),元素周期表第三周期第15族非金屬元素,元素符號P,原子序數15,相對原子質量30.973762。磷有多種同素異形體,如白磷(或黃磷)、紅磷等。白磷有兩種形態,在通常狀態下,白磷是一種蠟狀白色固體,純化後的白磷是無色透明的。白磷不溶於水,但可溶於二硫化碳。白磷在空氣中會發生自燃,生成P4O10;當暴露在陽光照射下或在隔絕空氣加熱到250℃的情況下時,白磷會轉化為紅磷。紅磷不會發生自燃,危險性也比白磷要低一些。紅磷相當穩定,並可在1個標準大氣壓、417℃時升華。
磷是一種生命必需的元素,存在於神經組織、骨骼和細胞質中。
磷用於製造磷肥、磷酸、煙火、火柴、殺蟲劑、磷青銅等。
基本介紹
- 中文名:磷
- 外文名:Phosphorus
- CAS登錄號:7723-14-0
- EINECS登錄號:231-768-7
- 熔點:44.1 ℃(白磷)
- 沸點:280 ℃(白磷)
- 水溶性:不溶於水
- 密度:1.82 g/cm(白磷)
- 外觀:紫紅色或白色粉末
- 套用:磷肥、磷酸、煙火、火柴、殺蟲劑、磷青銅
- 安全性描述:S7;S43;S61;S43C;S45;S38;S26;S5;S27;S6
- 危險性符號:R11
- 危險性描述:F;C;N;T+
- UN危險貨物編號:1338
研究簡史,理化性質,物理性質,化學性質,製備方法,工業製備,實驗室製備,套用領域,分布情況,安全措施,危害防治,安全標誌,毒理資料,生理作用,儲存運輸,儲存方法,運輸方法,
研究簡史
關於磷元素的發現,還得從歐洲中世紀的鍊金術說起。那時候,盛行著鍊金術,據說只要找到一種聰明人的石頭──哲人石,便可以點石成金,讓普通的鉛、鐵變成貴重的黃金。鍊金術家仿佛瘋子一般,採用稀奇古怪的器皿和物質,在幽暗的小屋裡,口中念著咒語,在爐火里煉,在大缸中攪,朝思暮想尋覓點石成金的哲人石。
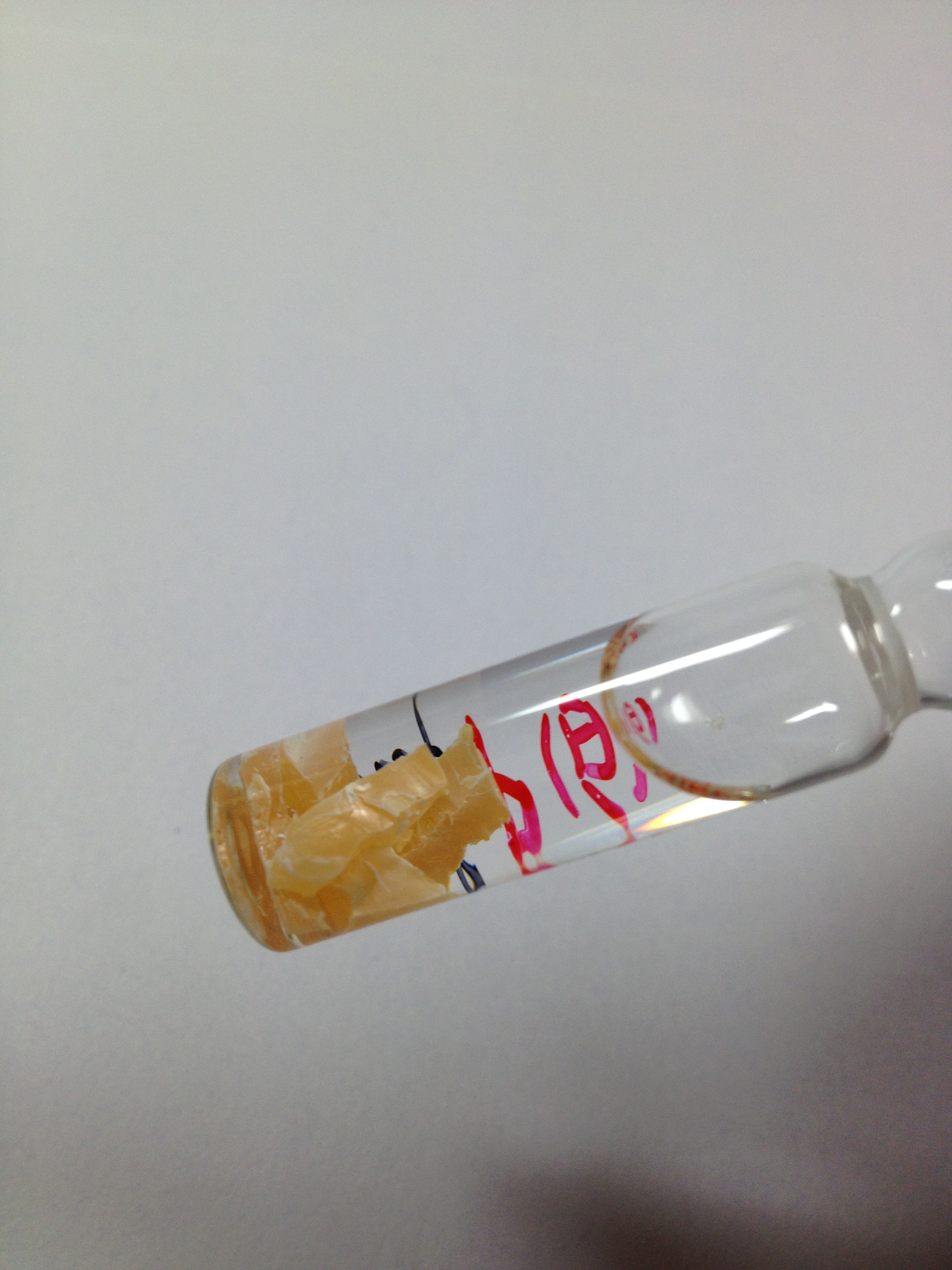 白磷
白磷1669年,德國漢堡一位叫布蘭德(Brand H)的商人在尿液中發現了磷,其每個實驗室用了至少50—60桶尿液,並且花費了至少兩個星期才完成。
2022年6月26日,中國林學會發布了“十三五”期間林草科技十大進展。其中包括,創製典型森林、濕地生態系統功能提升理論與技術。揭示濕地關鍵脫氮微生物類群及其作用機制、低溫反應及“基質—水”界面磷的吸附解析過程。
2023年6月,在
土衛二的海洋中檢測到生命的關鍵組成元素磷,這些磷以磷酸鹽的形式存在。
理化性質
物理性質
單質磷有幾種同素異形體:
黑磷,黑色晶體,不能燃燒,相對密度為2.7g/cm,不溶於
二硫化碳和
濃硫酸;
紅磷,紅褐色立方晶體或無定形粉末,無毒,相對密度為2.34g/cm,熔點590℃(4.356MPa),200—280℃自燃,極微溶於冷水,不溶於熱水、二硫化碳、乙醚和液氨,溶於
無水乙醇;
紫磷,紫色晶體,相對密度為2.36g/cm,熔點590℃,不溶於有機溶劑;黃磷,又稱白磷,黃色或白色晶體或蠟狀固體,有毒,相對密度為1.82g/cm(20℃),熔點44.1℃,沸點280℃,不溶於冷水,微溶於熱水和乙醇,溶於二硫化碳、苯、液氨、鹼、乙醚、氯仿和
甲苯。
 紅磷
紅磷 化學性質
暴露在潮濕空氣中的白磷會在暗處發光,是一種化學發光(燃燒)過程。操作白磷時必須要非常小心。白磷在室溫下就可以自燃,形成
五氧化二磷——實際上是十氧化四磷(P
4O
10)。
在精心控制的條件(75%O
2,25%N
2,50℃,90mmHg)下,會生成混合物,其中的部分產物是
三氧化二磷——實際上則是六氧化四磷(P
4O
6)。
白磷(P4)在室溫下同所有的鹵素單質的反應都很迅速,其反應產物是三鹵化磷。磷與氟氣(F2)、氯氣(Cl2)、溴單質(Br2)、碘單質(I2)分別反應生成氟化磷(Ⅲ)(PF3)、氯化磷(Ⅲ)(PCl3)、溴化磷(Ⅲ)(PBr3)和碘化磷(Ⅲ)(PI3)與過量的氟氣和氯氣與磷反應可以生成五鹵化物五氟化磷(PF5)和五氯化磷(PCl5):
溴和碘沒有類似的反應。
白磷(P4)同碘(I2)在二硫化碳(CS2)中發生反應,可以生成碘化磷(Ⅱ)P2I4。在180℃時,紅磷和碘(I2)之間的反應也會生成相同的化合物。
製備方法
工業製備
工業上主要使用那些富含磷的磷酸鹽礦作為生產磷的原料。生產時需要在電爐中與沙子和碳一起加熱磷酸鹽,這是一種高度能源密集型的生產方式。
這個反應會產生中間產物“五氧化二磷”——P4O10。
實驗室製備
磷非常易於實現工業生產,在實驗室中通常無需製備磷。一般來說,可以從尿液中萃取磷。
套用領域
白磷主要用於生產熱法磷酸、三氯化磷、三氯氧磷、五硫化二磷等磷化合物及供製造敵百蟲、甲胺磷、殺蟲脒、殺螟松、敵敵畏等有機磷農藥和滅鼠藥的原料。少量用於生產赤磷和五氧化二磷。軍事上用於製造燃燒彈、曳光彈、煙幕彈和信號彈。也用於生產磷鐵合金以及醫藥,有機原料等工業。
 白磷彈
白磷彈紅磷用於製備半導體化合物及用作半導體材料摻雜劑,可用於阻燃聚烴類、聚苯乙烯、聚酯、尼龍、聚碳酸酯、聚甲醛、環氧樹脂、不飽和樹脂、橡膠、紡織品等;而對聚對苯二甲酸乙二醇酯、聚碳酸酯以及酚醛樹脂等含氧高聚物的阻燃尤為有效。與其他磷系阻燃劑相比,相同質量的紅磷能產生更多的磷酸,磷酸即可覆蓋於被阻燃材料表面,又可在材料表面加速脫水碳化,形成液膜和碳層可將外部的氧,揮發性可燃物和熱與內部的高聚物基質隔開而使燃燒中斷。由於紅磷在達到同樣的阻燃要求時用量較小,而且紅磷的熔點高,溶解性差,因而以紅磷阻燃的高聚物的某些物理性能比用一般阻燃劑製得的同類高聚物要好。紅磷與鹵系阻燃劑並用,可提高阻燃效率。
白磷應保存在水中,且必須浸沒在水下,隔絕空氣。儲存於陰涼、通風良好的專用庫房內。庫溫應保持在1℃以上。遠離火種、熱源。應與氧化劑、酸類、鹵素、食用化學品分開存放,切忌混儲。
紅磷儲存於陰涼、通風的庫房。庫溫不超過35℃,相對濕度低於80%。遠離火種、熱源。應與氧化劑、鹵素、鹵化物等分開存放,切忌混儲。
運輸方法
運輸時運輸車輛應配備相應品種和數量的消防器材及泄漏應急處理設備。裝運本品的車輛排氣管須有阻火裝置。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與氧化劑、鹵素、鹵化物、等混裝混運。運輸途中應防曝曬、雨淋,防高溫。中途停留時應遠離火種、熱源。車輛運輸完畢應進行徹底清掃。鐵路運輸時要禁止溜放。
















