簡介
煤作為我國動力生產的主要原料,在工業生產和日常生活中使用十分廣泛,而且蘊藏蔓十分豐富.所以進行強化煤的燃燒研究,探討以煤代油的途徑,對節約能源,降低燃燒成本,具有十分重要的意義.
近年來,研究者使用了眾多的催化燃燒的方法,但是從化學動力學角度出發,1988年,曾經有人使用碳酸鉀,碳酸鈉和碳酸鈣對煤的點火性能進行了研究。在研究過程中,他們使用了工業煤試樣,點火裝置採用。碳酸鹽對煤的燃燒有較明顯的催化作用.用工業煤粉作為實驗試樣,存在以下缺點:燃燒時間短,燃燒後表明有堅硬的灰殼,不易觀察燃燒過程,在大多數情況下,燃燒不夠完全,而且燃燒後產生的固體灰分也能對燃燒過程起催化作用。
.
炭粒的著火
著火:燃料由緩慢氧化狀態轉變到高速燃燒狀態的瞬間過程稱為著火。
改善著火的措施:
加強放熱:增加可燃混合物的濃度、壓力以及可燃混合物的初溫
減小散熱:減小氣流速度,增加混合物初溫
煤粉氣流的著火
著火熱來源:卷吸周圍高溫煙氣並接受高溫火焰的輻射
著火熱:包括加熱煤粉及一次風,並使煤粉中水分加熱、蒸發、過熱所需熱量
影響著火熱的因素:
1.燃料性質(揮發分、水分、灰分、煤粉細度)
2.一次風溫、一次風速、一次風量
3.爐內散熱條件
4.燃燒器結構特性
5.鍋爐負荷
穩定著火過程的常用方法:
(1)組織強烈的煤粉氣流與高溫煙氣的混合
(2)提高一次風溫、採用合適的一次風量和風速
(3)採用較細的煤粉和敷設衛燃帶
煤粉燃燒的三個階段
(1)著火前的準備階段
煤粉氣流噴入爐內至著火這一階段為著火前的準備階段。著火前的準備階段是吸熱階段。在此階段內,煤粉氣流被煙氣不斷加熱,溫度逐漸升高。煤粉受熱後,首先是水分蒸發,接著乾燥的煤粉進行熱分解並析出揮發分。一般認為,從煤粉中析出的揮發分先著火燃燒。揮發分
燃燒放出的熱量又加熱炭粒,炭粒溫度迅速升高,當炭粒加熱至一定溫度並有氧補充到炭粒表面時,炭粒著火燃燒。
(2)燃燒階段
煤粉著火後進入燃燒階段。燃燒階段是一個強放熱階段。煤粉顆粒的著火燃燒首先從局部開始,然後迅速擴展到整個表面。煤粉氣流一旦著火燃燒,可燃質與氧發生高速的燃燒化學反應、放出大量的熱量,放熱量大於周圍水冷壁的吸熱量,煙氣溫度迅速升高達到最大值,氧濃度及飛灰含碳量則急劇下降。
(3)燃盡階段
燃盡階段是燃燒過程的繼續。煤粉經過燃燒後,炭粒變小,表面形成灰殼,大部分可燃物已經燃盡,只剩少量未燃盡繼續燃燒。在燃盡階段中,氧濃度相應減少,氣流的擾動減弱,燃燒速度明顯下降,燃燒放熱量小於水冷壁吸熱量,煙溫逐漸降低,因此燃盡階段占整個燃燒階段的時間最長。
炭粒的燃燒機理
炭粒表面燃燒過程:
溫度低於1200℃
 溫度低於1200℃
溫度低於1200℃溫度高於1200℃
 溫度高於1200℃
溫度高於1200℃燃燒:當燃料與氧化劑屬於同一形態,稱為均相燃燒或單相燃燒;當燃料與氧化劑不屬於同一形態,稱為多相燃燒,例如固體燃料在空氣中的燃燒。
煤粉燃燒的關鍵是其中炭粒的燃燒。這是因為:
焦炭中的碳是大多數固體燃料可燃質的主要成分;
焦炭的燃燒過程是整個燃燒過程中最長的階段,在很大程度上它能決定整個粒子的燃燒時間;
焦炭中碳燃燒的放熱量占煤發熱量的40%(泥煤)~95%(無煙煤)它的發展對其他階段的進行有著決定性的影響。因此,煤粉的整個燃燒過程中,關鍵在於組織好焦炭中炭的燃燒。
碳粒的燃燒機理是比較複雜的。大多數研究認為,碳與氧作用同時生成CO2和CO,其反應式為:
C+O2→CO2
2C+O2 →2CO
上述反應式稱為一次反應,其反應生成的CO2和CO還伴隨有下述反應,即:
CO2+C →2CO
2CO+O2 →2CO2
上述反應式稱為二次反應,反應中生成的CO和CO2稱為二次產物。
碳粒在靜止的空氣中燃燒:
碳粒在靜止的空氣中或碳粒與空氣兩者無相對運動燃燒時,在不同溫度下,上述這些反應以不同方式組合成碳粒的燃燒過程。
當溫度低於1200℃時,按下示反應式進行燃燒反應:
4C+3O2 → 2CO+2CO2
此時由於溫度較低,在碳粒表面生成的C02不能與C發生上式所示氣化反應。
當溫度高於1200℃以後,碳粒燃燒開始轉向如下反應:
3C+2O2 →2CO+CO2
此時,由於溫度升高加速了碳粒表面的反應,生成更多的CO。同時氣化反應也因溫度升高而顯著地進行。CO在向外擴散途中遇到遠處向碳粒表面擴散的氧而產生燃燒,並將氧全部消耗掉。反應生成的C02同時向碳粒表面和周圍環境兩方擴散。
燃燒速度和燃燒區域
(1)氧氣從周圍環境擴散到炭粒的表面
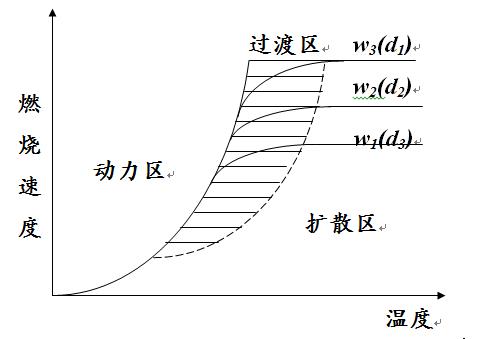 燃燒區域
燃燒區域(2)氧氣被炭粒表面吸附
(3)在炭粒表面進行的燃燒化學反應
(4)燃燒產物由炭粒解吸附
(5)燃燒產物離開炭粒表面,擴散到周圍環境中
CO火焰對碳粒燃燒影響
碳顆粒在氧化性氣氛中的燃燒是包括多種表面反應及氣相反應的複雜系統.現代燃燒理論的連續膜模型已從理論上闡明了碳粒表面氧化反應一次產物CO與O2的空間反應對碳粒表面溫度及其總體反應速率的影響是極其複雜的[’〕.然而,由於高度非線性的氣相燃燒與碳粒表面反應熱質禍合理論處理的複雜性,及捕捉持續時間極短的顆粒表面CO火焰的實驗測量的困難性,在煤粉燃燒的反應動力學實驗研究及煤粉火焰數學模型的研究領域內,目前人們普遍採用的仍是假定CO在顆粒邊界層中不燃燒的單膜模型.理論計算表明,CO能否在顆粒表面附近被點燃及其所引起的顆粒表面溫度差可高達數百度.這一顆粒表面溫度計算的不確定性,對煤粉的燃盡、燃料N的釋放以及NO二生成和控制過程的數值模擬的影響是巨大的.正因為如此,這一課題至今仍是煤燃燒理論工作者們關注的熱點之一.
CO的空間反應與碳粒表面反應的相互作用及其對碳粒表面溫度、總體反應速率的影響是極其複雜的.而CO能否在顆粒表面附近被點燃及其所引起的顆粒表面溫度差可高達數百度.
在實際煤粉火焰條件下,單膜模型和嚴格的連續膜模型的預報結果相差比較大,特別是對著火點及著火後某段區間內的顆粒溫度的預報,是僅考慮表面氧化反應C+1/2O2 →CO的單膜模型所無法完成的,這說明了單膜模型存在較大的套用局限性。
碳酸鈉對碳粒燃燒的影響
碳酸鈉對燃燒過程的強化主要是通過降低碳氧反應的活化能來實現的.碳原子的活化能與石墨的晶格結構有很大關係,晶格表面和邊緣處的碳原子活性最大.碳酸鈉對燃燒的催化,由其化學性質可知,主要發生在700--1300℃.由於Na2CO3的暫時介入使石墨晶格扭曲,碳原子活性增加,使C3O4更容易脫離晶格分解為CO和CO2,同時加速了C3O4的形成與分解。在溫度高於950℃時,部分Na2CO3分解為Na20和 CO2,該反應使石墨晶格扭曲程度加劇,碳原子活性進一步提高,CO:和C3O4的撞擊使C3O4分解加速.相對來說Na2O3分解生成的CO:在空氣中擴散,對C30。離解平衡的影響不大.在溫度大於1275℃時,Na2O升華,催化作用失去,碳粒由於結構變得相對疏鬆,燃燒繼續加劇,直至燒盡.
 溫度低於1200℃
溫度低於1200℃ 溫度高於1200℃
溫度高於1200℃ 燃燒區域
燃燒區域
