基本介紹
- 中文名:砹
- 外文名:Astatine
- 原子量:210
- 元素類型:非金屬單質
- 元素符號:At
- 形態:固態
- 發現人:科森
- 共價半徑:150 pm
- 電負性標度:Pauling scale:2.2
- 導熱性:1.7 W/(m·K)
- CAS號:7440-68-8
- 熔點:575K
- 密度:6.35±0.15 g/cm
- 氧化態:-1,+1,+3,+5,+7
基本信息,物理性質,化學性質,砹同位素的核性質,毒性,發現簡史,套用領域,
基本信息
【中文名稱】砹
【漢語拼音】ài
【英文名稱】astatine
【CAS號】7440-68-8[5]
【元素符號】At
【原子序數】85
【周期系列】6 【族-系列】ⅦA—鹵素
【密度】(At2)6.35±0.15g/cm (r.t)
【莫氏硬度】無數據
【性狀】狀似金屬
【地殼中含量】3×10^-24 %
【相對原子質量】[210]
【共價半徑】127 pm
【價電子排布】[Xe]4f14 5d10 6s2 6p5
【價電子在每能級排布】2,8,18,32,18,7
【電子層】KLMNOP
【外圍電子層排布】6s26p5
【核電荷數】85
【氧化態】±1,3,5,7
【晶體結構】面心立方
物理性質
【物質狀態】固態、放射性
【熔點】575 K(302 ℃)
【沸點】643 K(370 ℃)
【摩爾體積】無數據
【汽化熱】無數據
【熔化熱】114 kJ/mol
【蒸氣壓】無數據
【聲速】無數據
【比熱】無數據
【電導率】1.7 W/(m·K)
【熱導率】15 W/(m·K)
【第一電離能】899.003kJ/mol(估計)
【同位素】砹-191至砹-229
【豐度】100%
【半衰期】8.1h
化學性質
砹是一種鹵族化學元素,屬於ⅦA族元素。它的化學符號是At,它的原子序是85。砹比碘像金屬。它的活潑性較碘低。砹是在1940年初次被合成的。除了用α粒子轟擊鉍人工合成, 鈾和釷也會自然地衰變成砹。砹已知的20多種同位素全都有放射性,半衰期最長的也只有8.1小時,所以在任何時候,地殼中砹的含量都少於50克。與銀化合生成難溶解的AgAt。
根據鹵素的顏色變化趨勢,分子量和原子序數越大,顏色就越深。因此,砹將可能成為近黑色固體,它受熱時升華成黑暗、紫色氣體(比碘蒸氣顏色深)。砹是鹵族元素中毒性最小、比重最大的元素。(放射性元素毒性都不小!)
化合物:砹是鐳、錒、釷這些元素自動分裂過程中的產物。砹本身也是放射性元素。 砹在大自然中又少又不穩定,壽命很短,這就使它們很難積聚,即使積聚到一克的純元素都是不可能的,這樣就很難看到它的“廬山真面目”。儘管數量這樣少,可是科學家卻還是製得了砹的同位素20種。
雖然這些化合物主要是理論研究,但也在核醫學上也有相關研究。砹有望與金屬離子形成離子鍵,如鈉。像其他鹵素可以輕易從砹鹽中將其置換出來。砹也可以與氫反應,形成砹化氫(HAt) ,其中當溶解在水中,形成氫砹酸。一些砹化合物實例是:NaAt(砹化鈉)、MgAt2(砹化鎂)、CAt4(砹化碳)、AgAt(砹化銀)、At2O7(七氧化二砹)。
砹有-1、0、+1、+3、+5、+7等6種價態。它在溶液中的化學性質類似碘,當砹以游離元素形式存在於溶液中時,它可以被苯萃取。溶液中的元素砹可以被SO2還原,也可以被溴氧化。在鹵族元素中砹最具正電性,它的具有共沉澱特性的氧化態類似於碘離子、游離碘和碘酸離子的氧化態。強氧化劑可使砹產生 一個砹酸離子,但得不到高砹酸離子 (perastatate),游離的砹極易獲得。砹易沉積在銅、鉍和銀的表面上,也易沉積在含不溶的硫化物的沉澱中和新沉澱的碲元素上,砹這方面的性質和釙相似。
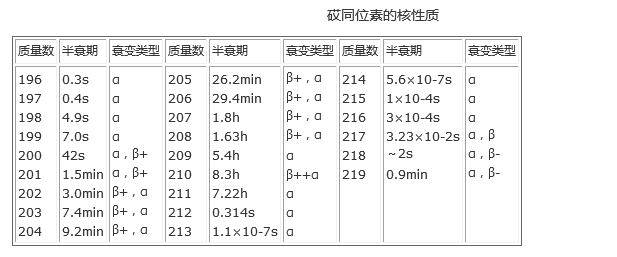
砹同位素的核性質
毒性
砹本身無毒,但其放出的射線對人體有害。動物實驗證明,211At類似碘,易為人身的甲狀腺所吸收。因此,砹放射出的α粒子對甲狀腺組織起破壞作用。
發現簡史
剛開始,化學家們根據門捷列夫的推斷——類碘是一個鹵素,是成鹽的元素,就嘗試從各種鹽類里去尋找它們,但是一無所獲。
1925年7月英國化學家費里恩德特地選定了炎熱的夏天去死海,尋找它們。但是,經過辛勞的化學分析和光譜分析後,卻絲毫沒有發現這個元素。
後來又有不少化學家嘗試利用光譜技術以及利用原子量作為突破口去找這個元素,但都沒有成功。
1931年,美國阿拉巴馬州工藝學院物理學教授阿立生宣布,在王水和獨居石作用的萃取液中,發現了85號元素。元素符號定為Ab。可是不久,磁光分析法本身被否定了,利用它發現的元素也就不可能成立。
1940年,義大利化學家埃米利奧·吉諾·塞格雷發現了第85號元素,它被命名為“砹(At)”。在希臘文里,砹(Astatium)的意思是“不穩定”。西格雷後來遷居到了美國,和美國科學家科里森、麥肯齊在加州大學伯克利分校用“原子大炮”——回旋加速器加速氦原子核,轟擊金屬鉍209,由此製得了第85號元素——“亞碘”,就是砹。
砹是一種非金屬元素,它的性質同碘很相似,並有類似金屬的性質。砹很不穩定,它剛出世8.3小時,便有一半砹的原子核已經分裂變成別的元素。
後來,人們在鈾礦中也發現了砹。這說明在大自然中存在著天然的砹。不過它的數量極少,在地殼中的含量只有10個億億億分之一,是地殼中含量最少的元素之一。
自然界存在的砹都是天然放射性衰變系的衰變產物。砹的天然放射性同位素有5At、At、At和2At等4種。在鈾礦物中存在痕量的短壽命的砹同位素;在鐳族放射性同位素中的鐳A進行很微小的分支衰減時,產生 一個半衰期為2s的同位素At;在鈳鈾系中的鈳K進行很微小的分支衰減時,產生 一個半衰期為0.9s的219At。砹在地殼中的存在量極微少,只有4×102 3,總量少於28.4g(約1英兩)。用人工放射方法已發現質量數在196~219間全部砹同位素。
套用領域
砹除了最穩定同位素以外,由於極其短暫的半衰期在科學研究方面沒有實際套用,但較重的同位素有醫療用途。砹211是由於放出α粒子且半衰期為7.2小時這些特點,已被套用於放射治療。在小鼠的研究結果顯示,砹211-碲膠體可以有效治療而不會產生毒性,破壞正常組織。相比之下,放出β射線的含磷32的磷酸鉻膠體則沒有抗腫瘤活性。這一驚人的不同之處最令人信服的解釋是緻密電離和極小範圍的α粒子排放。這些成果在以α粒子為放射源放療人類腫瘤的開發和利用上具有重要意義。
資源砹已經用於醫療中。在診斷甲狀腺症狀的時候,常常用放射性同位素碘131。碘131放出的砹射線很強,影響腺體周圍的組織。而砹很容易沉積在甲狀腺中,能起碘131同樣的作用。它不放射砹射線,放出的砹粒子很容易為機體所吸收。製備:


 砹
砹