基本介紹
- 中文名:瞬間偶極
- 外文名:instantaneous dipole
- 屬性:分子間極性
- 所屬領域:無機化學,分析化學
- 相關知識:偶極矩,范德華力
- 產生作用力:色散力
定義
產生原因
形成分子力
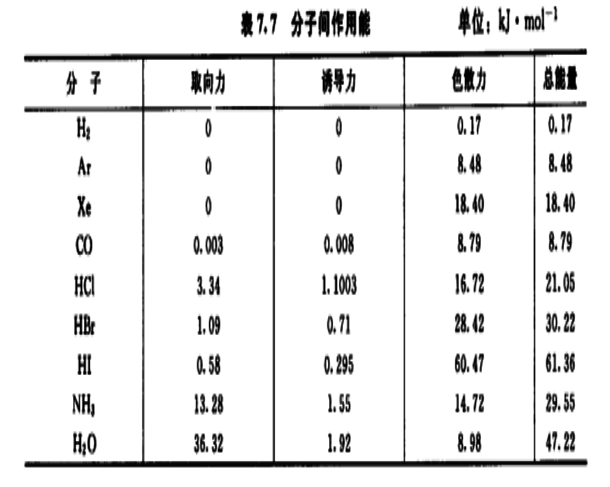
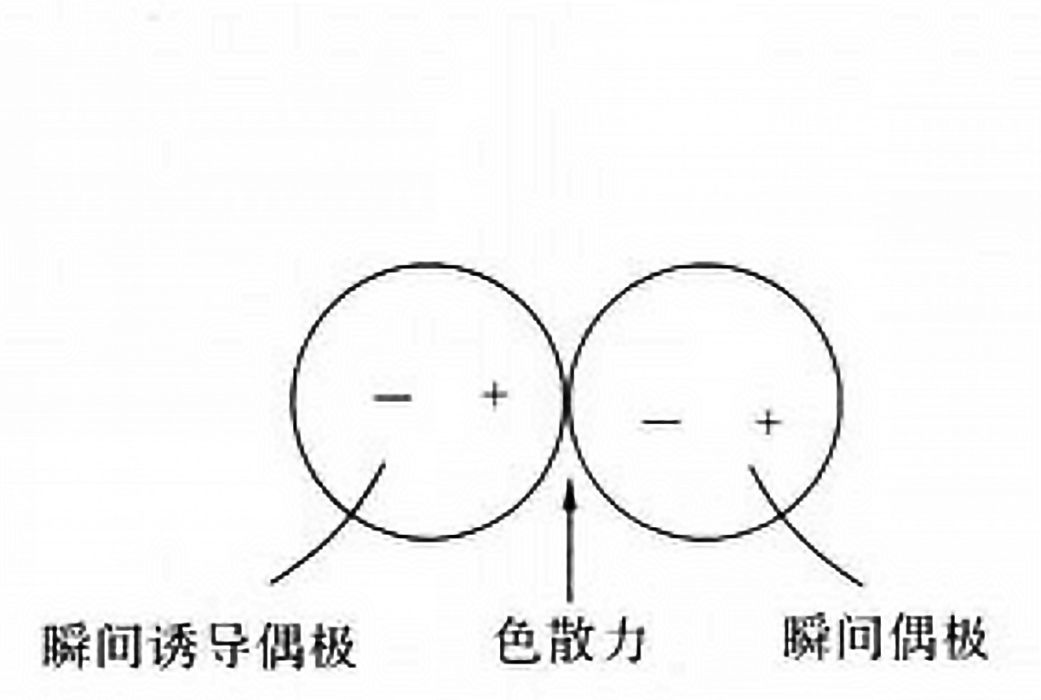

分子間作用力與分子的極性有關。分子的極性不但取決於分子中鍵的極性,而且取決於分子的幾何形狀。分子的極性與偶極矩(dipole moment)有關。偶極矩是表示分子中電荷分布狀況的物理量。當非極性分子相互接近時,由於分子...
偶極,外文名稱是dipole,表示分子的極性。可以分為三類:固有偶極、誘導偶極、瞬間偶極。分類 偶極可以分為三類:固有偶極:極性分子中由於組成元素不同,其吸引電子的能力各有差異(元素周期律),這就使得分子中有電子偏移的現象,這樣就產生了極性,並且偶極持續存在,稱為固有偶極。誘導偶極:是指非極性分子在電場...
色散力(dispersion force),又稱倫敦力,是指分子相互靠攏時,它們的瞬時偶極矩之間產生的很弱的吸引力。色散力存在於一切分子之間。任何一個分子,都存在著瞬間偶極,這種瞬間偶極也會誘導鄰近分子產生瞬間偶極,於是兩個分子可以靠瞬間偶極相互吸引在一起。這種瞬間偶極產生的作用力稱為色散力。色散力是菲列茲·倫敦...
傳統定義,將分子間作用力定義為:“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。隨著研究的深入,發現了許多用現有分子間作用力的作用機理無法說明的現象。比如鹵鍵,有機汞鹵化物時觀察到分子內鹵素原子與汞原子之間存在長距離強的共價相互作用力,從而引入二級價鍵力(secondary valence forces)的概念。現在學術上,...
非紅外活性振動(Non infrared vibration absorption)當振動過程中分子的瞬間偶極矩不發生變化時,不產生紅外光的吸收,這種現象稱為非紅外活性振動。把能引起偶極矩變化的振動稱為紅外活性振動;不能引起偶極矩變化的振動稱為非紅外活性振動。非紅外振動吸收的定義 非紅外活性振動當振動過程中分子的瞬間偶極矩不發生變化...
誘導力主要存在於極性分子與非極性分子之間,是由極性分子的永久偶極與其他分子的誘導偶極之間的相互作用引起的,其大小與分子偶極距的平方和極化率的乘積成正比,與分子間距離的六次方成反比。色散力是由於分子間瞬間偶極的相互作用引起的,其作用能大小與兩種分子的電離能和極化率,以及分子間的距離有關。(2)氫鍵:...
③非極性分子之間,由於組成分子的正、負微粒不斷運動,產生瞬間正、負電荷重心不重合,而出現瞬時偶極。這種瞬時偶極之間的相互作用力,叫做色散力能。分子量越大,色散力越大。當然在極性分子與非極性分子之間或極性分子之間也存在著色散力。范德華引力是存在於分子間的一種不具有方向性和飽和性,作用範圍在幾百個...
傳統定義,將分子間作用力定義為:“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。隨著研究的深入,發現了許多用現有分子間作用力的作用機理無法說明的現象。比如鹵鍵,有機汞鹵化物時觀察到分子內鹵素原子與汞原子之間存在長距離弱的共價相互作用力,從而引入二級價鍵力(secondary valence forces)的概念。 現在學術上,已經...
首先,將一塊由無極分子組成的均勻電介質放在外電場中時,由於分子中的正、負電荷受到相反方向的電場力,因而正、負電荷中心將發生微小的相對位移,從而形成電偶極子,其電偶極矩將沿外電場方向排列起來。這時,沿外電場方向電介質的前後兩表面也將分別出現正、負極化電荷。這是彈性的、瞬間完成的、不消耗能量的一種...
取向力(dipole-dipole attraction)又稱定向力,是極性分子與極性分子之間的固有偶極與固有偶極之間的靜電引力稱為取向力,又叫定向力。因為兩個極性分子相互接近時,同極相斥,異極相吸,使分子發生相對轉動,極性分子按一定方向排列,並由靜電引力互相吸引。當分子之間接近到一定距離後,排斥和吸引達到相對平衡,從而...
是分子的瞬時偶極間的作用力,即由於電子的運動,瞬間電子的位置對原子核是不對稱的,也就是說正電荷重心和負電荷重心發生瞬時的不重合,從而產生瞬時偶極。色散力和相互作用分子的變形性有關,變形性越大(一般分子量愈大,變形性愈大)色散力越大。色散力和相互作用分子的電離勢(即為電離能)有關,分子的電離勢...
