可待因,①各種原因引起的劇烈乾咳和刺激性咳嗽,尤適用於伴有胸痛的劇烈乾咳。由於本品能抑制呼吸道腺體分泌和纖毛運動,故對有少量痰液的劇烈咳嗽,應與祛痰藥並用。②可用於中等度疼痛的鎮痛。③局部麻醉或全身麻醉時的輔助用藥,具有鎮靜作用。
2018年9月4日,為進一步保障公眾用藥安全,國家藥品監督管理局決定對含可待因感冒藥說明書“禁忌”“兒童用藥”項進行修訂。其中,“禁忌症”中相關內容修訂為“18歲以下青少年兒童禁用”,“兒童用藥”中相關內容修訂為“18歲以下青少年兒童禁用本品”。
基本介紹
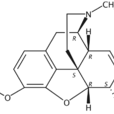
- 中文名:可待因
- 英文名:Morphinan-6-ol;Codeine
- 別稱:17-甲基-3-甲氧基-4,5α-環氧-7,8-二去氫嗎啡喃-6α-醇
- 化學式:C18H21NO3
- 分子量:299
- 熔點:157.5℃
- 沸點:250℃
理化性質,藥理學,適應症,用法和用量,不良反應,禁忌症,注意事項,藥物相互作用,製劑,藥典介紹,修訂事項,
理化性質
常用其磷酸鹽,為白色細微的針狀結晶性粉末。無臭,有風化性,水溶液顯酸性反應。在水中易溶,在乙醇中微溶,在三氯甲烷或乙醚中極微溶解。
藥理學
能直接抑制延腦的咳嗽中樞,止咳作用迅速而強大,其作用強度約為嗎啡的1/4。也有鎮痛作用,約為嗎啡的1/12~1/7,但強於一般解熱鎮痛藥。其鎮痛、呼吸抑制、便秘、耐受性及成癮性等作用均較嗎啡弱。口服吸收快而完全,其生物利用度為40%~70%。一次口服後,約1小時血藥濃度達高峰,t1/2約為3~4小時。易於透過血腦屏障及胎盤,主要在肝臟與葡萄糖醛酸結合,約15%經脫甲基變為嗎啡。其代謝產物主要經尿排泄。
適應症
①各種原因引起的劇烈乾咳和刺激性咳嗽,尤適用於伴有胸痛的劇烈乾咳。由於本品能抑制呼吸道腺體分泌和纖毛運動,故對有少量痰液的劇烈咳嗽,應與祛痰藥並用。②可用於中等度疼痛的鎮痛。③局部麻醉或全身麻醉時的輔助用藥,具有鎮靜作用。
用法和用量
由於劑型及規格不同,用法用量請仔細閱讀藥品說明書或遵醫囑。
不良反應
一次口服劑量超過60mg時,一些患者可出現興奮,煩躁不安、瞳孔縮小、呼吸抑制、低血壓、心率過緩。小兒過量可致驚厥,可用納洛酮對抗。亦可見噁心、嘔吐、便秘及眩暈。
禁忌症
18歲以下青少年兒童禁用。
注意事項
①長期套用亦可產生耐受性、成癮性。②妊娠期套用本品可透過胎盤使胎兒成癮,引起新生兒戒斷症狀,如腹瀉、嘔吐、打哈欠、過度啼哭等。分娩期套用可致新生兒呼吸抑制。③緩釋片必須整片吞服,不可嚼碎或掰開。
藥物相互作用
(1)本品與抗膽鹼藥合用時,可加重便秘或尿瀦留的不良反應。(2)與美沙酮或其他嗎啡類中樞抑制藥合用時,可加重中樞性呼吸抑制作用。(3)與肌肉鬆弛藥合用時,呼吸抑制更為顯著。(4)本品抑制齊多夫定代謝,避免二者合用。(5)與甲喹酮合用,可增強本品的鎮咳和鎮痛作用。(6)本品可增強解熱鎮痛藥的鎮痛作用。(7)與巴比妥類藥物合用,可加重中樞抑制作用。(8)與西咪替丁合用,可誘發精神錯亂,定向力障礙及呼吸急促。
製劑
片劑:15mg、30mg
藥典介紹
【鑑別】(1)取本品約0.2g,加水4ml溶解後,在不斷攪拌下滴加20%氫氧化鈉溶液至出現白色沉澱,用玻璃棒摩擦器壁使沉澱完全,濾過;沉澱用水洗淨,在105℃乾燥1小時,依法測定(附錄Ⅵ C),熔點為154~158℃。(2) 取本品約0.lg,加水5ml溶解後,滴加氨試液使成鹼性,不得生成沉澱。(3) 取本品約lmg,置白瓷板上,加含亞硒酸2.5mg的硫酸0.5ml,立即顯綠色,漸變藍色。(4) 本品的紅外光吸收圖譜應與對照的圖譜(光譜集 92圖)一致。(5) 本品的水溶液顯磷酸鹽的鑑別反應(附錄Ⅲ)。【檢查】 酸度 取本品0.4g,加水10ml溶解後,依法測定(附錄Ⅵ H),pH值應為4.0~5.0。溶液的澄清度與顏色 取本品0.4g,加新沸過的冷水10ml溶解後,溶液應澄清無色;如顯渾濁,與1號濁度標準液 ( 附錄Ⅸ B )比較,不得更濃;如顯色,與黃色2號標準比色液 (附錄Ⅸ A第一法)比較,不得更深。氣化物 取本品0.10g,依法檢查(附錄Ⅷ A),與標準氯 化鈉溶液5.Oml製成的對照液比較,不得更濃(0.05%)。硫酸鹽 取本品0.20g,依法檢査(附錄Ⅷ B),如發生渾 濁,與標準硫酸鉀溶液2.0ml製成的對照液比較,不得更濃 (0.1%)。有關物質 取本品,精密稱定,加流動相溶解並稀釋製成 每lml中含l0mg的溶液作為供試品溶液;另取嗎啡對照品, 精密稱定,用流動相溶解並稀釋製成每lml中含lmg的溶液 作為對照品溶液;精密量取供試品溶液0.2m1與對照品溶液 lml,置同一100ml量瓶中,用流動相稀釋至刻度,搖勻,作為對照溶液。照髙效液相色譜法(附錄V D)試驗,用十八烷基矽烷鍵合矽膠為填充劑;以0.03mol/L醋酸鈉溶液(用冰醋酸調節pH值至3.5)-甲醇(60:10)為流動相;檢測波長為 230nm;理論板數按磷酸可待因峰計箅不低於2000,嗎啡峰與 磷酸可待因峰的分離度應符合要求。取對照溶液10μl注入液相色譜儀,調節檢測靈敏度,使主成分色譜峰的峰高約為滿 量程的20%。再精密量取供試品溶液和對照溶液各10μl,分 別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的3倍, 供試品溶液的色譜圖中如有與嗎啡峰保留時間一致的色譜峰,其峰面積不得大於對照溶液中嗎啡峰面積(0.1% );其他單個雜質的峰面積不得大於對照溶液中磷酸可待因峰面積的2.5倍(0.5%);各雜質峰面積的和不得大於對照溶液中磷酸可待因峰面積的5倍(1.0%)。乾燥失重 取本品,在105℃乾燥至恆重,減失重量應為 5.0%~7.5% (附錄Ⅷ L)。【含量測定】取本品約0.25g,精密稱定,加冰醋酸10ml溶解後,加結晶紫指示液1滴,用髙氯酸滴定液(O.lmol/L)滴 定至溶液顯綠色,並將滴定的結果用空白試驗校正。每lml 高氯酸滴定液(O.lmol/L)相當於39.74mg的C18H21N03·H3PO4【類別】鎮痛藥,鎮咳藥。【貯藏】遮光,密封保存。
修訂事項
全文如下
為進一步保障公眾用藥安全,國家藥品監督管理局決定對含可待因感冒藥說明書【禁忌】、【兒童用藥】項進行修訂。現將有關事項公告如下:
一、所有含可待因感冒藥藥品生產企業均應當依據《藥品註冊管理辦法》等有關規定,按照含可待因感冒藥藥品說明書修訂要求(見附屬檔案),提出修訂說明書的補充申請,於2018年11月5日前報省級藥品監管部門備案。
修訂內容涉及藥品標籤的,應當一併進行修訂;說明書及標籤其他內容應當與原批准內容一致。在補充申請備案後6個月內對已出廠的藥品說明書及標籤予以更換。
各含可待因感冒藥藥品生產企業應當對新增不良反應發生機制開展深入研究,採取有效措施做好使用和安全性問題的宣傳培訓,指導醫師合理用藥。
修訂內容涉及藥品標籤的,應當一併進行修訂;說明書及標籤其他內容應當與原批准內容一致。在補充申請備案後6個月內對已出廠的藥品說明書及標籤予以更換。
各含可待因感冒藥藥品生產企業應當對新增不良反應發生機制開展深入研究,採取有效措施做好使用和安全性問題的宣傳培訓,指導醫師合理用藥。
二、臨床醫師應當仔細閱讀含可待因感冒藥藥品說明書的修訂內容,在選擇用藥時,應當根據新修訂說明書進行充分的效益/風險分析。
三、患者應當嚴格遵醫囑用藥,用藥前應當仔細閱讀說明書。
四、請省級藥品監管部門在日常監管中督促企業做好有關產品說明書修改和標籤說明書更換工作。
特此公告。
附屬檔案:含可待因感冒藥藥品說明書修訂要求
國家藥品監督管理局
2018年9月4日