概況
套用
生物工程的套用領域非常廣泛,包括農業、工業、醫學、藥物學、能源、環保、冶金、化工原料等。它必將對人類社會的政治、經濟、軍事和生活等方面產生巨大的影響,為世界面臨的資源、環境和人類健康等問題的解決提供美好的前景。
大學主要課程
主要課程:有機化學、生物化學、化工原理、
生化工程、微生物學、細胞生物學、遺傳學、生物化學、分子生物學、基因工程、
細胞工程、微生物工程、生化工程、生物工程
下游技術、
發酵工程設備等。
主要實踐性教學環節:包括教學實習、生產實習和畢業論文(畢業設計),教學實習和生產實習
一般安排10周,畢業論文(設計),一般安排10-20周。
修業年限:四至六年
授予學位:工學或理學學士
內容
基因工程
基因工程是指在基因水平上,按照人類的需要進行
設計,然後按設計方案創建出具有某種新的性狀的生物新品系,並能使之穩定地遺傳給後代。基因工程採用與工程設計十分類似的方法,明顯地既具有理學的特點,同時也具有
工程學的特點。生物學家在了解
遺傳密碼是RNA轉錄表達以後,還想從分子的水平去干預生物的遺傳。1973年,
美國史丹福大學的
科恩教授,把兩種
質粒上不同的抗藥基因"裁剪"下來,"拼接"在同一個質粒中。當這種雜合質粒進入大腸桿菌後,這種大腸桿菌就能抵抗兩種
藥物,且其後代都具有雙重抗菌性,科恩的重組實驗拉開了基因工程的大幕。
DNA重組技術是基因工程的核心技術。重組,顧名思義,就是重新組合,即利用供體生物的
遺傳物質,或人工合成的
基因,經過體外切割後與適當的載體連線起來,形成重組DNA分子,然後將重組DNA分子導入到受體細胞或受體生物構建轉基因生物,該種生物就可以按人類事先設計好的藍圖表現出另外一種生物的某種性狀。
DNA重組技術的物質基礎
(1)目的基因
基因工程是一種有預期目的的創造性工作,它的原料就是目的
基因;所謂目的基因,是指通過人工方法獲得的符合設計者要求的DNA片段。在適當條件下,目的基因將會以蛋白質的形式表達,從而實現設計者改造生物性狀的目標。
(2)載體
目的基因一般都不能直接進入另一種生物細胞,它需要與特定的載體結合,才能安全地進入到受體細胞中。目前常用的載體有
質粒、
噬菌體和病毒。
質粒是在大多數細菌和某些
真核生物的細胞中發現的一種環狀DNA分子,它位於細胞質中。許多質粒含有在某種環境下可能是必不可少的
基因。
噬菌體是專門感染細菌的一類
病毒,由蛋白質外殼和中心的核酸組成。在感染細菌時,噬菌體把DNA注入到細菌里,以此DNA為模板,複製DNA分子,併合成蛋白質,最後組裝成新的噬菌體。當細菌死亡破裂後,大量的噬菌體被釋放出來,去感染下一個目標。
質粒、噬菌體和病毒的相似之處在於,它們都能把自己的DNA分子注入到
宿主細胞中並保持DNA分子的完整,因而,它們成為運載目的基因的合適載體。因此,基因工程中的載體實質上是一些特殊的DNA分子。
(3)工具酶基因工程需要有一套工具,以便從生物體中分離目的基因,然後選擇適合的載體,將目的基因與載體連線起來。DNA分子很小,其直徑只有20埃(10-10米)。基因工程實際上是一種“超級顯微工程”,對DNA的切割、縫合與轉運,必須有特殊的工具。
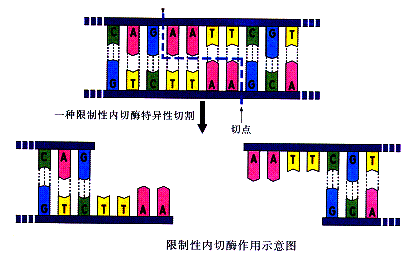 限制酶切割產生的粘性末端
限制酶切割產生的粘性末端1968年,科學家第一次從大腸桿菌中提取出了
限制性內切酶。限制性內切酶最大的特點是專一性強,能夠在DNA上識別特定的
核苷酸序列,並在特定切點上切割DNA分子。70年代以來,人們已經分離提取了400多種限制性內切酶。有了它,人們就可以隨心所欲地進行DNA分子長鏈切割了。表4-3是一些限制性內切酶的
識別位點1976年,5個實驗室的科學家幾乎同時發現並提取出一種酶,作DNA連線酶。從此,DNA連線酶就成了 “粘合”
基因的“分子粘合劑”。
DNA重組技術的一般操作步驟
一個典型的DNA重組包括五個步驟:
目前,獲取目的基因的方法主要有三種:
反向轉錄法、從細胞基因組直接分離法和人工合成法。
反向轉錄法是利用mRNA
反轉錄獲得目的基因的方法。現在用這種方法人們已先後合成了家兔、鴨和人的
珠蛋白基因、羽毛角蛋白基因等。
從細胞基因組中直接分離目的基因常用"鳥槍法",因為這種方法猶如用散彈打鳥,所以又稱"散彈槍法"。用"鳥槍法"分離目的基因,具有簡單、方便和經濟等優點。許多病毒和
原核生物、一些真核生物的
基因,都用這種方法獲得了成功的分離。
化學合成目的基因是20世紀70年代以來發展起來的一項新技術。套用化學合成法,可在短時間內合成目的基因。科學家們已相繼合成了人的生長激素釋放
抑制素、
胰島素、干擾素等蛋白質的編碼基因。
體外重組是把載體與目的基因進行連線。例如,以
質粒作為載體時,首先要選擇出合適的
限制性內切酶,對目的基因和載體進行切割,再以DNA連線酶使切口兩端的脫氧核苷酸連線。於是目的基因被鑲嵌進質粒DNA,重組形成了一個新的環狀DNA分子(雜種DNA分子)。
(3)DNA重組體的導入
把目的基因裝在載體上後,就需要把它引入到受體細胞中。導入的方式有多種,主要包括轉化、轉導、
顯微注射、微粒轟擊和電擊穿孔等方式。轉化和轉導主要適用於細菌一類的原核生物細胞和酵母這樣的低等
真核生物細胞,其他方式主要套用於高等動植物的細胞。
(4)受體細胞的篩選
由於DNA重組體的轉化成功率不是太高,因而,需要在眾多的細胞中把成功轉入DNA重組體的細胞挑選出來。應事先找到特定的標誌,證明導入是否成功。 例如,我們常用抗生素來證明證明導入的成功。
目的基因在成功導入受體細胞後,它所攜帶的
遺傳信息必須要通過合成新的蛋白質才能表現出來,從而改變受體細胞的遺傳性狀。目的基因在受體細胞中要表達,需要滿足一些條件。
例如,目的基因是利用受體細胞的核糖體來合成蛋白質,因此目的基因上必須含有能啟動受體細胞核糖體工作的功能片段。
這五個步驟代表了基因工程的一般操作流程。人們掌握
基因工程技術的時間並不長,但已經獲得了許多具有實際套用價值的成果。基因工程作為現代生物技術的核心,將在社會生產和實踐中發揮越來越重要的作用。
細胞工程
細胞培養技術是細胞工程的基礎技術。所謂細胞培養,就是將生物有機體的某一部分組織取出一小塊,進行培養,使之生長、分裂的技術。細胞培養又叫組織培養。近二十年來細胞生物學的一些重要理論研究的進展,例如
細胞全能性的揭示,
細胞周期及其調控,癌變機理與
細胞衰老的研究,基因表達與調控等,都是與
細胞培養技術分不開的。
體外細胞培養中,供給離開整體的動植物細胞所需營養的是培養基,培養基中除了含有豐富的營養物質外,一般還含有刺激
細胞生長和發育的一些微量物質。培養基一般有固態和液態兩種,它必須經滅菌處理後才可使用。此外,溫度、光照、振盪頻率等也都是影響培養的重要條件。
第一步,從健康植株的特定部位或組織,如根、莖、葉、花、果實、花粉等,選擇用於培養的起始材料(
外植體)。
第二步,用一定的化學藥劑(最常用的有次
氯酸鈉、
升汞和
酒精等)對外植體表面消毒,建立無菌培養體系。
第三步,形成
愈傷組織和器官,由愈傷組織再分化出芽並可進一步誘導形成小植株。
動物細胞培養有兩種方式。一種叫非
貼壁培養:也就是細胞在培養過程中不貼壁, 條件較為複雜, 難度也大一些,但是容易同時獲得大量的培養細胞。這種方法一般用於淋巴細胞、腫瘤細胞和一些
轉化細胞的培養。另一種培養方式是貼壁培養:也稱為細胞貼壁,貼壁後的細胞呈單層生長,所以此法又叫
單層細胞培養。大多數
哺乳動物細胞的培養必須採用這種方法。
動物細胞不能採用離體培養,以人的皮膚
細胞培養為例,動物細胞培養的主要步驟如下:
第一步,在無菌條件下,從健康動物體內取出適量組織,剪下成小薄片。
第二步,加入適宜濃度的酶與輔助物質進行消化作用使細胞分散。
第三步,將分散的細胞進行洗滌並純化後,以適宜的濃度加在
培養基中,37℃下培養,並適時進行傳代。(圖4-31)
在細胞培養中,我們經常使用一個詞——克隆。克隆一詞是由英文clone音譯而來,指無性繁殖以及由無性繁殖而得到的細胞群體或生物群體。
細胞克隆是指細胞的一個
無性繁殖系。自然界早已存在天然的克隆,例如,同卵雙胞胎實際上就是一種克隆。
基因工程中,還有稱為分子克隆(molecular cloning)的,是
科恩等在 1973年提出的。
分子克隆發生在DNA分子水平上,是指從一種細胞中把某種
基因提取出來作為
外源基因,在體外與載體連線,再將其引入另一受體細胞自主複製而得到的DNA分子無性系。
由於克隆是無性繁殖,所以同一克隆內所有成員的遺傳構成是完全相同的,這樣有利於忠實地保持原有品種的優良特性。人們開始探索用人工的方法來進行高等
動物克隆。哺乳動物克隆的方法主要有
胚胎分割和細胞核移植兩種。其中,細胞核移植是發展較晚但富有潛力的一門新技術。
細胞核移植技術屬於細胞質工程。所謂細胞核移植技術,是指用機械的辦法把一個被稱為“供體細胞”的細胞核(含遺傳物質)移入另一個除去了細胞核被稱為“
受體”的細胞中,然後這一重組細胞進一步發育、分化。核移植的原理是基於
動物細胞的細胞核的
全能性。
採用細胞核移植技術克隆動物的構想,最初由一位德國胚胎學家在1938年提出。從1952年起,科學家們首先採用兩棲類動物開展細胞核移植克隆實驗,先後獲得了蝌蚪和成體蛙。1963年,我國
童第周教授領導的科研組,以金魚等為材料,研究了魚類
胚胎細胞核移植技術,獲得成功。到1995年為止,在主要的哺乳動物中,胚胎細胞核移植都獲得成功,但成體動物已分化細胞的核移植一直未能取得成功。
1996年,英國
愛丁堡羅斯林研究所,
伊恩·維爾穆特研究小組成功地利用細胞核移植的方法培養出一隻克隆羊——
多利,這是世界上首次利用成年哺乳動物的
體細胞進行細胞核移植而培養出的克隆動物。圖4-33克隆羊示意圖。
在
核移植中,並不是所有的細胞都可以作為核供體。作為供體的細胞有兩種:一種是胚胎細胞,一種是某些體細胞。
研究表明,卵細胞、
卵母細胞和受精卵細胞都是合適的受體細胞。
核移植的研究,不僅在探明動物細胞核的全能性、細胞核與細胞質關係等重要理論問題方面具有重要的科學價值,而且在畜牧業生產中有著非常重要的經濟價值和套用前景。
3、細胞融合技術
細胞融合技術屬於細胞融合工程。細胞融合技術是一種新的獲得
雜交細胞以改變細胞性能的技術,它是指在離體條件下,利用融合誘導劑,把同種或不同物種的體細胞人為地融合,形成雜合細胞的過程。細胞融合術是細胞遺傳學、細胞免疫學、
病毒學、腫瘤學等研究的一種重要手段
第一步,獲取親本細胞。將取樣的組織用胰蛋白酶或機械方法分離細胞,分別進行
貼壁培養或
懸浮培養。
第二步,誘導融合。把兩種親本細胞置於同一培養液中,進行
細胞融合。動物細胞的融合過程一般是:兩個細胞緊密接觸→細胞膜合併→細胞間出現通道或細胞橋→細胞橋數增加擴大通道面積→兩細胞融合為一體。
第二步,誘導融合。
微生物細胞的融合步驟與植物細胞融合基本相同。
從20世紀70年代開始,已經有許多種細胞融合成功,有植物間、動物間、動植物間甚至人體細胞與動植物間的成功融合的新的雜交植物,如 “西紅柿馬鈴薯”、“擬南芥油菜”和“蘑菇白菜”等。(圖4-36是利用細胞融合培育雜交植物)從目前的技術水平來看,人們還不能把許多遠緣的細胞融合後培養成雜種個體,尤其是動物細胞難度更大。
發酵工程
現代的
發酵工程。又叫微生物工程,指採用現代生物工程技術手段,利用微生物的某些特定的功能,為人類生產有用的產品,或直接把微生物套用於工業生產過程。發酵是微生物特有的作用,幾千年前就已被人類認識並且用來製造酒、麵包等食品。20世紀20年代主要是以
酒精發酵、
甘油發酵和丙醇發酵等為主。20世紀40年代中期美國抗菌素工業興起,大規模生產青黴素以及日本
谷氨酸鹽(味素)發酵成功,大大推動了發酵工業的發展。

20世紀70年代,基因重組技術、細胞融合等生物工程技術的飛速發展,發酵工業進入
現代發酵工程的階段。不但生產
酒精類飲料、醋酸和麵包,而且生產
胰島素、干擾素、生長激素、抗生素和疫苗等多種醫療保健藥物,生產天然殺蟲劑、
細菌肥料和微生物除草劑等農用生產資料,在化學工業上生產胺基酸、香料、生物高分子、酶、維生素和單細胞蛋白等。
從廣義上講,
發酵工程由三部分組成:上游工程,發酵工程和
下游工程。其中上游工程包括優良種株的選育,最適發酵條件(pH、溫度、
溶解氧和營養組成)的確定,營養物的準備等。發酵工程主要指在最適發酵條件下,發酵罐中大量培養細胞和生產代謝產物的工藝技術。下游工程指從發酵液中分離和純化產品的技術。
發酵工程的步驟一般包括:
第一步,菌種的選育。
第三步,擴大培養和接種。
第四步,發酵過程。
發酵工程在醫藥工業、食品工業、農業、冶金工業、環境保護等許多領域得到廣泛套用。
酶工程
酶工程是指利用酶、細胞或細胞器等具有的特異催化功能,藉助
生物反應裝置和通過一定的工藝手段生產出人類所需要的產品。它是
酶學理論與化工技術相結合而形成的一種新技術。
酶工程,可以分為兩部分。一部分是如何生產酶,一部分是如何套用酶。
酶的生產大致經歷了四個發展階段。最初從動物內臟中提取酶,隨著酶工程的進展,人們利用大量培養微生物來獲取酶,
基因基因工程誕生後,通過
基因重組來改造產酶的微生物,近些年來,酶工程又出現了一個新的熱門課題,那就是人工合成新酶,也就是
人工酶。
酶在使用中也存在著一些缺點。如遇到高溫、強酸、強鹼時就會失去活性,成本高,價錢貴。實際套用中酶只能使用一次等。利用酶的固定化可以解決這些問題,它被稱為是
酶工程的中心。
60年代初,科學家發現,許多酶經過固定化以後,活性絲毫未減,穩定性反而有了提高。這一發現是酶的推廣套用的轉折點,也是酶工程發展的轉折點。如今,酶的
固定化技術日新月異。它表現在兩方面:
一是固定的方法。目前固定的方法有四大類:吸附法、共價鍵合法、
交聯法和
包埋法。
二是被固定下來的酶,具有多種酶,能催化一系列的反應。
1.可以做成各種形狀,如顆粒狀、管狀、膜狀,裝在反應槽中,便於取出,便於連續、反覆使用。
2.穩定性提高,不易失去活性,使用壽命延長。
如今已有數十個國家採用固定化酶和固定化細胞進行工業生產,產品包括
酒精、啤酒、各種胺基酸、各種有機酸以及藥品等等。
 限制酶切割產生的粘性末端
限制酶切割產生的粘性末端