基本介紹
甘汞電極是由汞、甘汞和氯化鉀溶液組成的參比電極。又稱“甘汞參比電極”或“甘汞半電池”。在一定溫度下,當KCl溶液中的Cl濃度固定時,甘汞電極電位就是定值,因此它可作為參比電極。常用的甘汞電極有以飽和氯化鉀溶液為內參比溶液的飽和甘汞電極和用1摩爾KCl(氯化鉀)溶液為內參比溶液的標準(當量)甘汞電極等。甘汞電極是由金屬汞、甘汞(HgCl
2)及氯化物(常用KCl)溶液製成的。其結構見圖。它屬於第二類電極,是對陰離子(Cl)有所謂
能斯特(W.H.Nernst,1864—1941,物理化學家)回響的電極。結構如下:
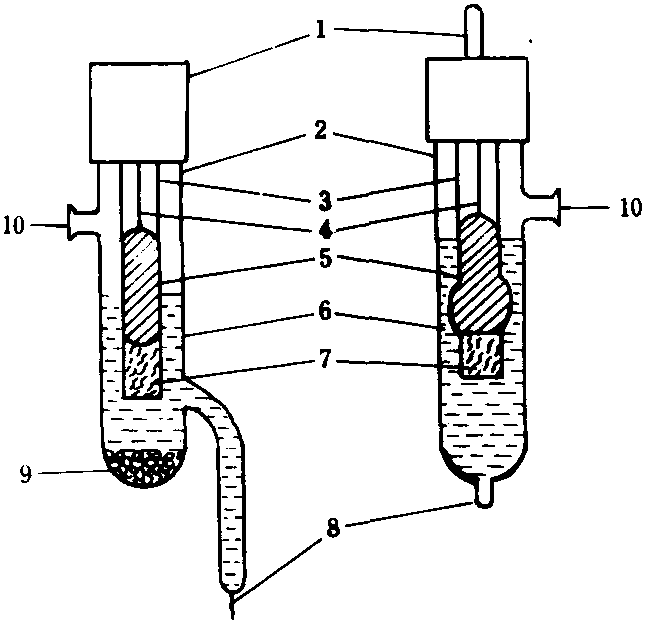 甘汞電極結構
甘汞電極結構1. 導線(接線柱) 2. 外套管 3. 內套管 4.Pt絲5.Hg、HgCl2混合物 6. 內參比溶液 7.棉花8. 塞石棉的毛細孔 9.KCl晶體 10. 加液孔
用途及用法
由於單個電極的電勢無法測量,通常借用
標準氫電極作為參考電極來測定電極的相對電動勢值。但是標準氫電極雖然穩定,但操作麻煩,所以常用重現性好、又比較穩定的甘汞電極作為參考電極。甘汞電極是汞和甘汞與不同濃度的KCl溶液組成的電極,它的電極電勢可以與標準氫電極組成電池而精確測定,所以又稱這種電極為二級標準電極。
電極的種類一般分為四種:金屬-金屬離子電極、氣體-離子電極、金屬-金屬難溶鹽電極以及氧化還原電極。甘汞電極在電極的分類中屬於金屬-金屬難溶鹽電極。
甘汞電極在70℃以上時電位值不穩定,在100℃以上時電極只有9小時的壽命,因此甘汞電極應在70℃以下使用,超過70℃時應改用銀—氯化銀電極。
甘汞電極其電極反應和電極符號分別為:
電極符號:Pt|Hg(l)|Hg2Cl2(s)| KCl(飽和)
電極反應式:Hg2Cl2+2e=2Hg+2Cl-
銀-氯化銀電極其電極反應和電極符號分別為:
電極符號: Ag(s)|AgCl(s)|Cl(c)
電極反應式: AgCl+e=Ag+Cl-
參比電極
參比電極又稱“參考電極”。由於單個電極的電極電位無法直接測出,所以在測定一個電極的電極電位時,必須另配上一個已知電極電位的電極,使成為一個電池。在測定此電池的電動勢後,才可以標出被測電極的電極電位。此種配上的已知電極電位的電極,稱為“參比電極”。
一級參比電極的電極電位一般取為零。以標準氫電極(SHE)為一級參比電極而測出的電極電位稱為“氫標電極電位”或標準電極電位。常用的二級參比電極有甘汞電極與氯化銀電極,它們的氫標電極電位均已精確測定,因此欲測電極與它們配對組成電池後,可以很方便地由測定的電池電動勢算得它的氫標電極電位。汞電極是另一種一級參比電極, 它規定電極上的電荷相對於溶液為零時的 電極電位為零,以之測得的電極電位稱為 “絕對電位”,這種電極較少套用。
 甘汞電極結構
甘汞電極結構
