基本介紹
- 中文名:理想功和損耗功
- 外文名:ideal work and lost work
- 記號:W(id)、W(L)
- 理想功條件:系統變化要在完全可逆條件下進行
- 損耗功特點:損耗功的值為非負值
- 套用領域:化工熱力學
定義
理想功

損耗功

穩定流動過程的理想功
計算公式



推導過程




















注意事項
非流動過程的封閉系統理想功的計算
計算公式


推導過程
穩定流動過程的損耗功
計算公式



推導過程










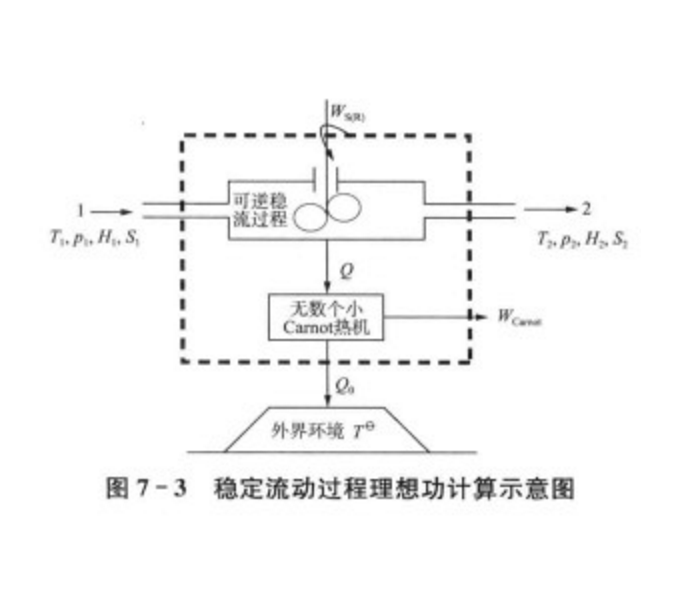








































理想功代表一個生產過程所能提供的最大有用功,是一切實際過程功能損耗大小的比較標準,理想功與實際功的比較可為生產過程改革提供依據。要獲得理想功,系統的變化必須要在完全可逆的條件下進行。所說的“完全可逆”是指系統內部所有變化...
252理想功(Wid)(也稱最大可用技術功)36 253損失功(WL)(也稱損耗功)37 254熱力學效率(ηT)39 26能量的分析法40 261(exergy)與平衡方程40 262常見類型的計算42 263常見化工過程的...
二、理想功(Wid)(也稱最大可用技術功)43 三、損失功(WL)(也稱為損耗功)44 四、熱力學效率(ηT)任務五分析法的套用47 一、(exergy)與平衡方程47 二、常見類型的計算49 三、常見化工過程的分析套用51 知識窗日常生活用...
3.2理想功和損耗功56 3.2.1理想功56 3.2.2損耗功61 3.2.3熱力學效率63 3.3有效能和無效能65 3.3.1有效能65 3.3.2有效能的計算67 3.3.3無效能75 3.4有效能衡算和有效能效率77 3.4.1有效能衡算77 3.4.2有效...
5.2理想功與損耗功/122 5.2.1理想功/122 5.2.2不可逆過程的損耗功/127 5.3.3熱量炯與冷量/133 5.3.4物理炯/134 5.3.5化學/137 5.3.6兩種損失和兩種效率 /139 5.4典型化工單元過程熱力學分析/140 5.4.1流體流動...
4.1 理想功與損耗功 4.2 有效能與環境模型 4.3 蒸汽動力循環 4.4 製冷循環 4.5 氣體液化循環 參考文獻 習題和思考題 第5章 化工過程用能的熱力學分析 5.1 化工過程熱力學分析的基本方法 5.2 可避免的炯損失與不可避免的...
理想功 理想功是指體系的狀態變化完全按可逆過程進行時所表現出的功,即體系在做功過程中,在給定變化條件下所能夠完成的最大功量,或在消耗功的過程中所需的最小功,對於非流動體系,理想功為 W=T₀ΔS - ΔU - p₀ΔV ...
10.1理想功241 10.2損耗功242 10.3典型過程的分析244 10.3.1管內流動過程24410.3.2換熱過程244 10.3.3逆流換熱和順流換熱245 10.4能量最優原則246 思考題248 習題248 附錄250 附錄A單位換算係數與通用氣體常數250 附錄B純物質...
6.3.1 理想功 / 216 6.3.2 損失功 / 218 6.3.3 熱力學效率 / 220 6.4 損耗功分析 / 221 6.4.1 流體流動過程 / 221 6.4.2 傳熱過程的熱力學分析 / 222 6.4.3 傳質過程的熱力學分析 / 225 6.5 有效能 / ...
