熱力學原理是普通的規律。正因為它的普遍性,就不會具體化,就不能直接由此推算出具體體系的汽液平衡數據。反之,如果某一個具體體系的汽液平衡關係已經測出,則該特殊情況應該符合熱力學的普遍規律。若兩者不相符合,肯定可以認為是汽液平衡的實驗數據不夠正確,在測溫、測壓、組成分析或是否真正達到平衡等方面存在誤差,必須進行檢查並冉次進行汽液平衡的實驗,直至兩者符合後方能認可。這種用熱力學原理來校核實驗結果的可靠性的方法,稱為汽液平衡數據的熱力學一致性檢驗。
基本介紹
- 中文名:熱力學一致性檢驗
- 外文名:Thermodynamic consistency test
- 判斷依據:熱力學三大定律
- 判斷條件:氣液平衡相
- 理論基礎:物理化學
- 作用:可以對化學反應反應前的理論分析
熱力學平衡態,熱力學一致性檢驗的定性描述,氣液兩相的平衡和轉化,
熱力學平衡態
如果系統中所有狀態函式均不隨時間而變化,則稱系統處於熱力學平衡態(thermodynamicequilibrium state)。熱力學平衡態需要同時滿足以下平衡。
1、熱平衡 系統中各部分的溫度相同。系統內部不存在熱的傳遞。
2、力平衡 系統中各部分的壓強相同。系統中沒有不平衡的力存在。
3、相平衡 系統中相變達到平衡。系統中各相的組成和數量不變,即相與相之間不存在物質淨的轉移。
4、化學平衡 系統中化學反應達到平衡。系統中各物質的組成和數量不隨時間而變化。
滿足上述四種平衡是系統處於熱力學平衡態的必要條件,一旦某一個平衡被打破.則系統的狀態必然打破。
熱力學一致性檢驗的定性描述
由於氣液平衡儀器的套用不當或者組成的分析誤差,及溫度、壓力的測量誤差等原因,所得汽液平衡的數據往往不一定可靠,因此在套用已發表的數據時先用熱力學一致性檢驗其可取性是十分重要的。
現在根據對二組分體系汽液平衡數據的熱力學一致性作幾點定性的描述。假設根據已測得的汽液平衡數據作出兩條Inγi~Xi曲線圖,即lnγ1~X1曲線與Inγ2~ X2曲線。 如果這套數據是熱力學一致性的,則應該符合下列六條定性的規律:
(1)所有的數據點應落在光滑的曲線上,即應沒有分散的數據點。如果有任何落線上外的點,則表示該數據點有誤差。
(2) 當兩個活度係數曲線都是以X為橫坐標,則兩條曲線的斜率的符號一定相反。如果X1=X2=0.5時,兩條曲線的斜率應該互為相反數。
(3)如果兩個端值相等,則中點值約為端值的1/4;如果端值不等,端值高的曲線的中點值低,而端值低的曲線的中點值高。
(4)如果在Inγi~Xi曲線上不出現最高點及最低點,則在整個範圍內,兩條曲線的斜率一定都是正的或都是負的;如果一曲線上出現極大值或極小值,則在另一曲線上在同一組成處必然出現極小值或極大值。
(5)如果lnγi~Xi曲線符van Laar方程,則以(Inγ1)0.5對(Inγ2)0.5作圖時,應得一條直線。如不符合van Laar方程,則該線稍有曲變。
(6)在兩條lnγi~Xi的曲線下面所包括的面積應該彼此相等。
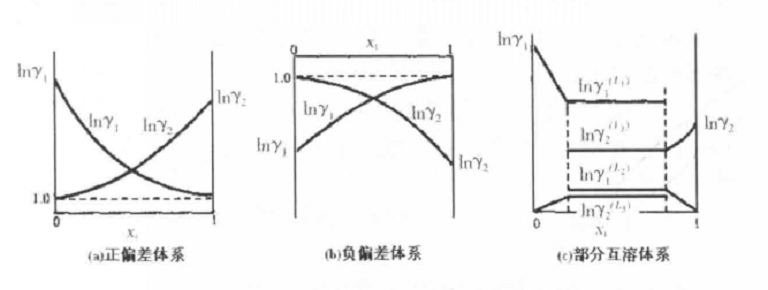 Inγi~Xi關係圖
Inγi~Xi關係圖氣液兩相的平衡和轉化
對於具有相同成分及相同物理、化學性質的均勻物質部分我們叫作相。 自然界中許多物質都具有固、液、氣三相。在一定的條件下,不同相之間可以相互轉變,稱為相變。根據相的定義,固體的不同晶體結構形態也屬於不同的相,相互間也可以發生相變。近代研究物質表面層中電子狀態的變化,也可以認為是一種相變。
1、 氣化
物質由液態轉變成氣態的過程叫做氣化,有蒸發和沸騰兩種形式。蒸發是液體表面所發生的氣化現象。開口杯中的水之所以會逐漸幹掉,就是因為杯內的水不斷蒸發成水蒸汽,而逸散到周圍空間中去的緣故。影響蒸發快慢的重要因素是溫度、蒸發表面和通風條件。溫度越高蒸發越快,因此,把濕衣服放在爐子旁邊要幹得快些;液體表面越大,蒸發也越快,因此曬衣服時總要把它晾開;通風越好,使從液體表面蒸發出來的分子排走得越快,蒸發就越迅速。密閉容器中,蒸發速度越來越慢,最後達到飽和,氣液兩相處於平衡共存狀態。
如果我們對液體繼續加熱,實驗發現,當液體溫度升高到某一數值時,液體內部產生大量氣泡。氣泡由液體內部上升到液面後,在液面破裂並放出大量蒸氣,這種在液體表面和內部同時進行的劇烈氣化的現象叫做沸騰,相應的溫度稱為沸點。由於沸騰是劇烈的氣化過程,這時外界供給的熱量全部用於液體的氣化,溫度停留在沸點不再上升,直到液體全部氣化為止。
從分子運動論的觀點來看,氣化是液體分子變成蒸氣分子的過程。分子要離開液面,就要克眼周圍液體分子的吸引力而作功,這就要消耗能量。因而在蒸發過程中,只有動能較大的分子才能逸出液面,結果使留下的液體分子的平均動能變小,從而使液體溫度下降。為了維持液體溫度不變,就要從外界吸收熱量。另一方面,在從液態分子轉變為氣態分子的過程中,分子之間的距離要增大,因而必須克服分子間的吸引力而作功,這也需要從外界吸收能量。這些因素合起來所需要從外界吸收的熱量,就是物質的氣化熱。顯然,溫度較高時,分子熱運動比較激烈,所需的氣化熱就較小。至於沸騰,情況和蒸發差不多,只是這時液體內部也產生氣泡,因而大大增加了氣體和液體之間的分界面。
當然,由於分子的熱運動,在蒸發過程里,一方面固然有動能較大的分子逸出液面,另一方面也存在著蒸氣分子不斷返回液體的情況,這是一個動態過程。在通風比較好的條件下,蒸氣分子不斷被帶走,蒸發的多,返回的少,所以蒸發進行得較快。但在密閉的情況下,最後總要達到在單位時間內進出液面的分子數相等的平衡狀態。這時與液體保持動態平衡的蒸氣就是飽和蒸氣。在一定溫度下,由於進出液面的分子數相等,飽和蒸氣密度不變,因而飽和蒸氣壓不變。而隨著溫度升高,分子動能增大,液體中足以逸出液面的分子數增加,飽和蒸氣密度變大,從而使得飽和蒸氣壓隨溫度的升高而變大。
2、液化
物質從氣態轉變成液態的過程叫作液化,也稱凝結。液化是氣化的反過程,隨著溫度的下降,飽和蒸氣中的蒸氣分子要凝結成液體,同時放出熱量,使液體溫度升高。單位質量的蒸氣在凝結時放出的熱量稱為凝結熱,數值上等於同溫度的氣化熱。要使蒸氣液化,也可用增加蒸氣壓的辦法來實現。 但這是有條件的,需要在在臨界溫度T0之上,無論如何壓縮氣體也無法使氣體液化。當原來已有液體存在時,降溫或減壓可以正常地液化氣體。但在原來只有氣態的情況下,蒸氣的凝結往往需要有凝結核,否則即使蒸氣壓力實際上已大大超過它的飽和蒸氣壓,往往還不發生凝結現象,而形成過飽和狀態。 凝結核是蒸氣分子藉以聚結成液滴的微粒,大多數是塵埃一類的東西,帶電的粒子和離子也都是很好的凝結核。
3、氣液兩相圖,克拉珀龍-克勞修斯方程
對於二氧化碳的等溫線,該曲線把p-V圖分成氣相、液相、氣液兩相共存等三個區域,因而可認為二氧化碳的相圖是氣液兩相圖。 但由於在相變過程中,P、T存在著一定的函式關係,所以通常人們習慣用p-T圖描寫相變。 而且,由於在p-V圖上,表示氣液共存區的是一塊面積,而在p-T圖中, 表示氣液共存區的只是一根曲線OC,因而用p-T圖描寫相變比用p-V圖更方便。下圖就稱為氣液兩相圖
 氣液兩相圖
氣液兩相圖曲線OC稱為氣化曲線。曲線上的點是兩相共存區,曲線的上方為液相區,下方為氣相區。氣化曲線的終點C就是臨界點,對應的溫度和壓力就是臨界溫度Tc和臨界壓力Pc。易見,T>Tc的區域也是氣相區域,氣化曲線的終點O溫度為T0,在溫度低於T0時,氣相只能與固相共存。

