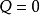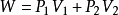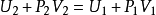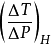起源
詹姆斯·普雷斯科特·焦耳是英國物理學家。主要成就:確立熱和機械功之間的當量關係——熱功當量,證明熱和機械能及電能的轉化關係,為能量守恆定律的建立打下堅實的實驗基礎,是能量守恆定律發現者之一;研究電流熱效應,給出焦耳楞次定律,並否定了“熱質說”,指出熱本質問題的研究方向;研究空氣膨脹和壓縮時的溫度變化規律,發現焦耳-湯姆生效應,是從分子動力學的立場出發深入研究氣體規律的先驅者之一。
在進行熱功當量測量實驗的同時,1844年開始,焦耳研究空氣在膨脹和壓縮過程中溫度變化規律,並取得了一些研究成果。計算出了氣體分子的熱運動速度值,從理論上奠定了波義耳-馬略特和蓋-呂薩克定律的基礎,並解釋了氣體對器壁壓力的實質。1845年,焦耳完成了氣體自由膨脹時降溫的試驗。1852年,焦耳和著名物理學家威廉·湯姆生(後來受封為開爾文勳爵)合作,改進試驗。1865年二人共同發表的論文中提出:當自由擴散氣體從高壓容器進入低壓容器時,大多數氣體和空氣的溫度都要下降。這一現象後來被稱為焦耳-湯姆生效應。這一試驗結論廣泛地套用於低溫和氣體液化等領域,因而可以說,焦耳是從分子動力學的立場出發進行深入研究的先驅者之一。焦耳和湯姆生的合作時間很長,在焦耳一生髮表的97篇科學論文中有20篇是他們的合作成果。
焦耳-湯姆生試驗
圖2-11中的裝置為一絕熱圓筒,中間用剛性多孔塞隔開。左側氣體的壓力、溫度為P
1、T
1,利用活塞緩慢推動,使在恆定P
1、T
1下有體積V
1的氣體通過多孔塞向右側膨脹。右側通過另一活塞使氣體壓力保持在P
1,使左側P
1、T
1條件下體積為V
1的氣體進入右側後壓力降為P
2,體積變為V
2,實驗中能夠測出右側氣體的溫度為T
2。
 焦耳-湯姆生試驗
焦耳-湯姆生試驗上述過程的始末態可分別表示為P
1、V
1、T
1及P
2、V
2、T
2。這種在絕熱條件下氣體的始末態分別保持壓力恆定的膨脹過程稱
節流膨脹。上述實驗即焦耳-湯姆生實驗。生產中恆壓流體流動時突然受阻,使壓力下降,即可認為屬此情況。
當始態為常壓及室溫時,多數氣體經節流膨脹後溫度下降,稱致冷效應。有些氣體如氫、氦等節流膨脹後溫度升高,產生致熱效應。實驗還可測得各種氣體在壓力足夠低時,則節流膨脹前後溫度基本不變。
基本原理
溫度下降:當氣體膨脹,
分子之間的平均距離上升。因為分子間吸引力,氣體的
位能上升。因為這是等熵過程,系統的總
能量守恆,所以位能上升必然會令
動能下降,故此溫度下降。
溫度上升:當分子
碰撞,位能暫時轉成動能。由於分子之間的平均距離上升,每段時間的平均碰撞次數上升,位能下降,因此動能上升,溫度上升。
低於反轉溫度時,前者的影響較為明顯,高於反轉溫度時,後者影響較明顯。
焦耳-湯姆生係數
節流膨脹過程的熱力學特徵,可用熱力學第一定律作如下分析:
過程的總功W是左側活塞推送V1體積的氣體通過多孔塞時所作的功與進入右側V2體積的氣體推動活塞所作功的代數和,故
即
上式說明節流膨脹過程始末態焓值相等,有時稱為等燴過程。因此,理想氣體經節流膨脹是不會發生溫度變化的。真實氣體心焓是溫度與壓力的函式,故節流膨脹使壓力改變
時,將引起溫度改變
。過程中溫度隨壓力的變化率可表示為
。下標H表示等焓過程。針對物系的某一狀態來說,這種變化率可表示為:
式中μ稱焦耳-湯姆生係數,或稱節流膨脹係數。由於膨脹過程dP總是負值,所以P值為正時dT應與dP同號,即dT為負值,這就表示節流引起了致冷效應,與此相反,μ值為負時則將引起致熱效應。μ值為零則表明節流後溫度不發生變化。
套用
卡爾·馮·林德利用焦耳-湯姆生效應來進行製冷。
套用焦耳-湯姆遜效應所研製出的氬氦刀,已在臨床上推廣套用,其關鍵技術是控制低溫區域和冷凍速率。
 焦耳-湯姆生試驗
焦耳-湯姆生試驗