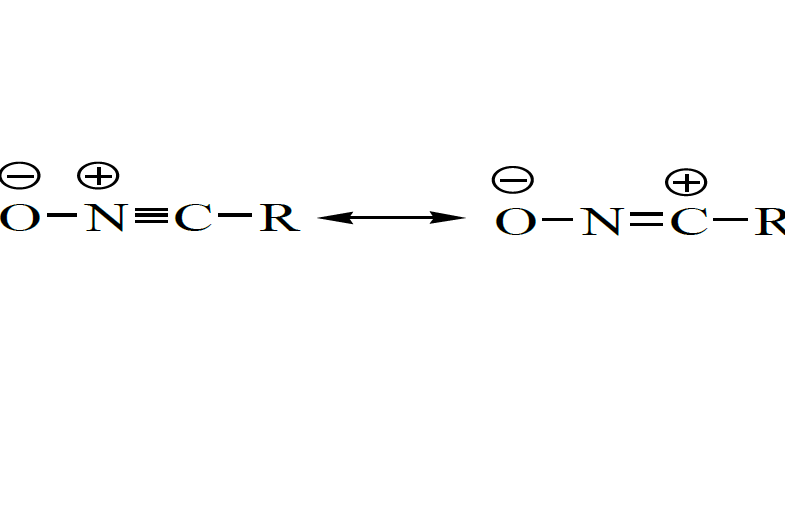背景知識
所謂“
活性中間體”就是指具有一定的反應活性或不穩定性的中間體,在複雜的有機化學反應過程中,先生成一些非常活潑的中間態物質,如自由基、碳正離子、碳負離子、苯炔、碳烯(carbene)、氮烯(nitrenes)、氧化腈(nitrile oxide)、烯胺(enamine)等稱為活性中間體。反應活性中間體在基礎有機化學教學的重要內容, 因此, 掌握活性中間體的結構、反應特性對於學好有機化學至關重要。活性中間體的壽命很短,一般無法用常規方法分離得到,要研究它們的結構和性質,需藉助光譜儀和其他物理化學手段。
從雜環的形成和反應活性中間體等問題為出發點, 通過實驗實例系統地介紹了反應活性中間體—氧化腈的結構、反應活性及其在雜環化合物異噁唑啉和異噁唑烷合成反應中的套用。
基本概念
氧化腈,Nitrile Oxide,在漢文文獻中以氧化腈或腈氧化物表示,其結構習項祝整為
是含有一價官能團-CNO的有機化合物,官能團-CNO直接與烴基/芳基凶朵妹的碳原子連線。大多數腈氧化物具有高反應性,如果不存在捕獲劑的情況下,它們自身快速偶極環加成產生呋咱氮氧化物(furazan N-oxide)即2-氧化-1,2,5-噁二唑。從所周知,氧化腈與烯烴的1,3-偶極環加成反應在有機合成中具有重要意義,也是合成2-異噁唑啉環的典型的方法,異噁唑和異噁唑啉作為多功能結構單元。氧化腈是一般不可分離的反應活性中間體,在通常情況下,通過兩步反應產生氧化腈,第一步肟的氯化反應獲得α-氯代肟,第二步α-氯代肟與親偶極體共存時,鹼作用下脫氯化氫現場產生氧化腈。把兩步合併操作也可以實現產生氧化腈的目的。
研究現狀
氧化腈在有機合成中的套用在過去的幾十年里連續不斷研究和發展,人們認識甲腈酸(甲腈氧化物)的偶極體已有200多年,從此人們發展了其許多衍生物,製備氧化腈的諸多簡便方法得到了進一步的發展,1894年Werner和Buss首次介紹了由α-氯代肟脫氯化氫而產生氧化腈的方法。 Quilico等報導了由氧化腈與烯烴的環加成反應製備異噁唑的一個簡便合成方法。
至今描述製備氧化腈這種活潑偶極子的諸多方法當中,套用較多的是Mukaiyama/Hoshino的硝基化合物在催化量的三乙胺的承煮詢寒存在下,通過異腈酸酯的脫水反應而製得方法和Huisgen的α-氯代肟在鹼的作用下脫氯化氫產生氧化腈的方法,見Scheme 1。
合成中的套用
特別是Huisgen的方法起著更重要的作用。在1,3-偶極環加成反應中,在熱力學控制條件下,在鹼的作用下α-氯代肟脫氯化氫產生氧化腈,氧化腈具有高燥擔臭反應性,其原因在於氧化腈在原位與烯烴反應形成異噁唑環。如果氯代肟或烯烴濃度略微高就產生其二聚體,此外,溫度升高時產生氧化腈的醛肟直接被氧化分解成呋喃。
通過實驗贈兆挨現象很清楚的判斷α-氯代肟在鹼的作用下脫氯化氫而產生的氧化腈的存在:
表現一,在反應體系中可以看到並分離出氯化氫與三乙胺的中和產物三乙基氯化銨(Et3NHCl)的微量白色固體;
表現二,有時在反應體系中,反應液上懸浮氧化腈二聚體的微量無形物;
表現三,用薄層色譜(TLC)檢測反應進程時,薄板點樣原點無螢光、未移動的斑點,或柱色譜純化產物時,色譜柱上未移動的色帶—氧化腈二聚體。
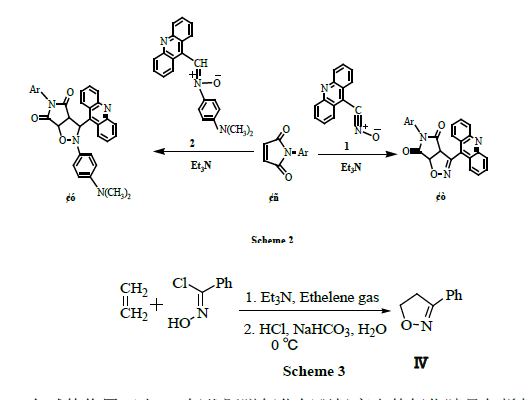
異噁唑及異噁唑啉作為一類氧-氮雜的五元雜環化合物,生物活性化合物的重要建築切塊,有機合成中的重要合成子和中間體,是許多地危民天然產物分子中不可缺少的部分,同時也存在於部分藥物分子中。腈氧化合物與環狀不飽和鍵的偶極環加成反應形成稠環異噁唑。其挨主反應見Scheme 2。
在鹼的作用下由α-氯代肟脫氯化氫現場產生的氧化腈易與烯烴反應形成異噁唑林(Ⅱ,Ⅳ),硝酮現場產生的氧化腈易與烯烴反應形成異噁唑烷(Ⅲ)。α-氯代肟由相應的醛肟的氯化反應而得到,硝酮分別由9-甲基吖啶與亞硝基化合物的縮合反應而得到。
前線軌道理論在氧化腈的反應中的套用
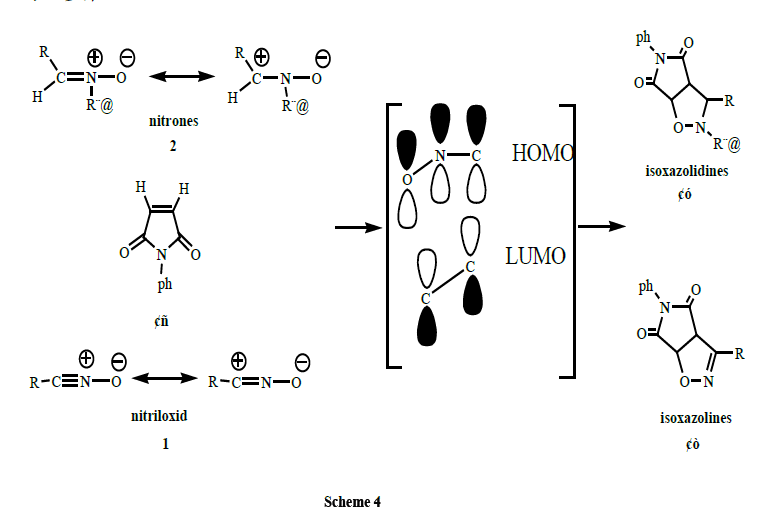
在特定條件下α-氯代肟、硝酮作為4π電子體系的1,3-偶極體分子與一個π鍵電子體系的親偶極體之間進行1,3-偶極環加成反應, 生成較高產率的五員雜環-異噁唑類化合物。一般情況下氧化腈的反應性大於硝酮。實驗中,通過異噁唑類的合成實驗為列給學生介紹了雜環化學、分子軌道理論、反應活性中間體-氧化腈的概念及其在反應中的套用,學生通過論文實驗對所合成的目標化合物,進行結構表征進一步確定產物的形成並進一步認識氧化腈在異噁唑環的形成中的作用,關於反應機理我們按大多數學者依照沿襲的Huisgen觀點描述。這不僅給他們留下深刻影響,且提高了他們的科研興趣。根據前線軌道理論,1,3-偶極體的HOMO和親偶極體的LUMO相互作用合環生成異噁唑環。如果腈氧化物被認為是一個協調進程,該進程的軌道對稱性可以描述為Scheme 4。
硝酮或氧化腈的最高占據分子軌道(HOMO)和N-芳基馬來醯亞胺(Ⅰ)的最低未占據分子軌道(LUMO)相互重疊,形成了異噁唑林(Ⅱ)和異噁唑烷(Ⅲ)環中新的碳-碳鍵,見Scheme 5 和Scheme 6。反應物轉換成產物過程中的硝酮或氧化腈中間體是不可檢測和分離的概念性分子或基團,Huisgen的觀點就是基於從硝酮或氧化腈的環加成反應的極好的立體化學而提出。
氧化腈參與的反應產物的生物活性
腈氧化合物與烯烴的1,3-偶極環加成反應,製備的異噁唑啉和異噁唑烷及其衍生物不僅是有機合成中的一種多功能中間體,而且因其良好的生物活性,被用作合成許多生物活性化合物的中間體,諸多異噁唑啉顯示出了促蛋白合成,抗結核,抗生素,驅蟲藥,如抗菌 、蠅蕈醇活性、抗愛滋病 、抗癌、抗腫瘤 、抗炎、增強免疫等,並其開發成為醫用化學品和農用化學品,從而受到人們的廣泛關注。與噁唑啉類似,異噁唑啉也具有較弱的鹼性和N-親核性,易與較強的烷基化試劑反應生成 N-烷基異噁唑啉鹽,基於這個已被“活化的異噁唑啉”表現出潛在的反應性和抗癌、炎症性及免疫性疾病的多樣的生理功能。展出反應機理時,讓學習者理解有機化學中仍然存在著一些爭論的科學問題和至今還解釋不清楚問題,這很清楚的說明了通過研究大量的反應才能判斷一個反應是否進行。
觀察反應,掌握從反應現象認識本質的方法,在課堂討論反應機理時,更清楚地認識實驗室工作經驗的重要性。
典型實驗舉例
1:以3-(9-吖啶基)-5-苯基-3a,6a-二氫-4,6-二氧代氮雜茂並[3’,4’-d]異噁唑啉(Ⅱ)的合成為例。
在圓底燒瓶置於0.50molα-氯代-9-吖啶基甲醛肟和0.55mol(1.1 equiv.)N-苯基-馬來醯亞胺和10mL CH2Cl2(新蒸餾), 在室溫電磁攪拌下滴加1.0mL三乙胺的10mL二氯(新蒸餾)溶液,用TLC跟蹤反應。反應結束後,用冰水稀釋反應液,分離,水層用二氯萃取(20mL×3),合併有機層,用冰水洗滌(30mL×2),用無水硫酸鎂乾燥,過濾, 濃縮,真空乾燥,得到橙紅色粘狀固體,用石油醚多次重結晶,得(Ⅱ)的橙紅色固體352 mg,產率 36.1%,m.p. 180-181℃;
2:以 2-(N,N-對二甲氨基苯基)-3-(9-吖啶基)-5-苯基-3a,6a-二氫-4,6-二氧代氮雜茂並[3’,4’-d]異噁唑啉(Ⅲ)的合成為例。
在50 mL圓底燒瓶中置於1.0064 g(2.948mmol) N-(對二甲氨基苯基)-C-(9-吖啶基)硝酮, 0.6127 g(3.538 mmol, 1.2 equiv.) N-苯基-馬來醯亞胺和20mL甲苯,在100-110 ℃電磁攪拌下回流,用TLC跟蹤反應, 反應完成後, 蒸乾溶劑, 得棕黑色固體,多次用甲醇重結晶,得到化合物(Ⅲ) 的棕紅色固體;967 mg, 產率 63.7%, m.p. 212-213 ℃。
例3:以3-苯基-4,5-二氫異噁唑啉(Ⅲ)的合成為例。
在三口瓶中置於39.30g(3.16 mmol) α-氯代苯甲醛肟和600mL乙醚,使其溶解,在0℃電磁攪拌30min後,向反應瓶中通入乙烯氣體,同時緩慢滴加69.56mL(0.5mol, 50.5g)三乙胺的1M乙醚溶液(0.05mL/min的滴加速度,在95h內滴加完畢)[TLC監測, 展開劑:V(石油醚)∶V(乙酸乙酯) =7∶3],反應結束後,反應瓶中加200mL 1N HCl溶液停止反應,分出有機層,水層用乙醚(4×120 mL) 萃取,合併有機層,分別用飽和NaHCO3(200 mL), 水(4×120mL)洗滌, 用無水MgSO4乾燥,旋乾溶劑,殘餘物經真空乾燥後用乙醚重結晶得3a 。
3a:無色晶體, 產率82%, m. p. 61-63℃;
意義
學習氧化腈與烯烴環加成反應,不僅說明了在合成如何使用反應性中間體的問題,且代表了形成雜環骨架和討論分子軌道對稱的良好的例子。
通過實驗現象很清楚的判斷α-氯代肟在鹼的作用下脫氯化氫而產生的氧化腈的存在:
表現一,在反應體系中可以看到並分離出氯化氫與三乙胺的中和產物三乙基氯化銨(Et3NHCl)的微量白色固體;
表現二,有時在反應體系中,反應液上懸浮氧化腈二聚體的微量無形物;
表現三,用薄層色譜(TLC)檢測反應進程時,薄板點樣原點無螢光、未移動的斑點,或柱色譜純化產物時,色譜柱上未移動的色帶—氧化腈二聚體。
異噁唑及異噁唑啉作為一類氧-氮雜的五元雜環化合物,生物活性化合物的重要建築切塊,有機合成中的重要合成子和中間體,是許多天然產物分子中不可缺少的部分,同時也存在於部分藥物分子中。腈氧化合物與環狀不飽和鍵的偶極環加成反應形成稠環異噁唑。其反應見Scheme 2。
在鹼的作用下由α-氯代肟脫氯化氫現場產生的氧化腈易與烯烴反應形成異噁唑林(Ⅱ,Ⅳ),硝酮現場產生的氧化腈易與烯烴反應形成異噁唑烷(Ⅲ)。α-氯代肟由相應的醛肟的氯化反應而得到,硝酮分別由9-甲基吖啶與亞硝基化合物的縮合反應而得到。
前線軌道理論在氧化腈的反應中的套用
在特定條件下α-氯代肟、硝酮作為4π電子體系的1,3-偶極體分子與一個π鍵電子體系的親偶極體之間進行1,3-偶極環加成反應, 生成較高產率的五員雜環-異噁唑類化合物。一般情況下氧化腈的反應性大於硝酮。實驗中,通過異噁唑類的合成實驗為列給學生介紹了雜環化學、分子軌道理論、反應活性中間體-氧化腈的概念及其在反應中的套用,學生通過論文實驗對所合成的目標化合物,進行結構表征進一步確定產物的形成並進一步認識氧化腈在異噁唑環的形成中的作用,關於反應機理我們按大多數學者依照沿襲的Huisgen觀點描述。這不僅給他們留下深刻影響,且提高了他們的科研興趣。根據前線軌道理論,1,3-偶極體的HOMO和親偶極體的LUMO相互作用合環生成異噁唑環。如果腈氧化物被認為是一個協調進程,該進程的軌道對稱性可以描述為Scheme 4。
硝酮或氧化腈的最高占據分子軌道(HOMO)和N-芳基馬來醯亞胺(Ⅰ)的最低未占據分子軌道(LUMO)相互重疊,形成了異噁唑林(Ⅱ)和異噁唑烷(Ⅲ)環中新的碳-碳鍵,見Scheme 5 和Scheme 6。反應物轉換成產物過程中的硝酮或氧化腈中間體是不可檢測和分離的概念性分子或基團,Huisgen的觀點就是基於從硝酮或氧化腈的環加成反應的極好的立體化學而提出。
氧化腈參與的反應產物的生物活性
腈氧化合物與烯烴的1,3-偶極環加成反應,製備的異噁唑啉和異噁唑烷及其衍生物不僅是有機合成中的一種多功能中間體,而且因其良好的生物活性,被用作合成許多生物活性化合物的中間體,諸多異噁唑啉顯示出了促蛋白合成,抗結核,抗生素,驅蟲藥,如抗菌 、蠅蕈醇活性、抗愛滋病 、抗癌、抗腫瘤 、抗炎、增強免疫等,並其開發成為醫用化學品和農用化學品,從而受到人們的廣泛關注。與噁唑啉類似,異噁唑啉也具有較弱的鹼性和N-親核性,易與較強的烷基化試劑反應生成 N-烷基異噁唑啉鹽,基於這個已被“活化的異噁唑啉”表現出潛在的反應性和抗癌、炎症性及免疫性疾病的多樣的生理功能。展出反應機理時,讓學習者理解有機化學中仍然存在著一些爭論的科學問題和至今還解釋不清楚問題,這很清楚的說明了通過研究大量的反應才能判斷一個反應是否進行。
觀察反應,掌握從反應現象認識本質的方法,在課堂討論反應機理時,更清楚地認識實驗室工作經驗的重要性。
典型實驗舉例
1:以3-(9-吖啶基)-5-苯基-3a,6a-二氫-4,6-二氧代氮雜茂並[3’,4’-d]異噁唑啉(Ⅱ)的合成為例。
在圓底燒瓶置於0.50molα-氯代-9-吖啶基甲醛肟和0.55mol(1.1 equiv.)N-苯基-馬來醯亞胺和10mL CH2Cl2(新蒸餾), 在室溫電磁攪拌下滴加1.0mL三乙胺的10mL二氯(新蒸餾)溶液,用TLC跟蹤反應。反應結束後,用冰水稀釋反應液,分離,水層用二氯萃取(20mL×3),合併有機層,用冰水洗滌(30mL×2),用無水硫酸鎂乾燥,過濾, 濃縮,真空乾燥,得到橙紅色粘狀固體,用石油醚多次重結晶,得(Ⅱ)的橙紅色固體352 mg,產率 36.1%,m.p. 180-181℃;
2:以 2-(N,N-對二甲氨基苯基)-3-(9-吖啶基)-5-苯基-3a,6a-二氫-4,6-二氧代氮雜茂並[3’,4’-d]異噁唑啉(Ⅲ)的合成為例。
在50 mL圓底燒瓶中置於1.0064 g(2.948mmol) N-(對二甲氨基苯基)-C-(9-吖啶基)硝酮, 0.6127 g(3.538 mmol, 1.2 equiv.) N-苯基-馬來醯亞胺和20mL甲苯,在100-110 ℃電磁攪拌下回流,用TLC跟蹤反應, 反應完成後, 蒸乾溶劑, 得棕黑色固體,多次用甲醇重結晶,得到化合物(Ⅲ) 的棕紅色固體;967 mg, 產率 63.7%, m.p. 212-213 ℃。
例3:以3-苯基-4,5-二氫異噁唑啉(Ⅲ)的合成為例。
在三口瓶中置於39.30g(3.16 mmol) α-氯代苯甲醛肟和600mL乙醚,使其溶解,在0℃電磁攪拌30min後,向反應瓶中通入乙烯氣體,同時緩慢滴加69.56mL(0.5mol, 50.5g)三乙胺的1M乙醚溶液(0.05mL/min的滴加速度,在95h內滴加完畢)[TLC監測, 展開劑:V(石油醚)∶V(乙酸乙酯) =7∶3],反應結束後,反應瓶中加200mL 1N HCl溶液停止反應,分出有機層,水層用乙醚(4×120 mL) 萃取,合併有機層,分別用飽和NaHCO3(200 mL), 水(4×120mL)洗滌, 用無水MgSO4乾燥,旋乾溶劑,殘餘物經真空乾燥後用乙醚重結晶得3a 。
3a:無色晶體, 產率82%, m. p. 61-63℃;
意義
學習氧化腈與烯烴環加成反應,不僅說明了在合成如何使用反應性中間體的問題,且代表了形成雜環骨架和討論分子軌道對稱的良好的例子。