基本介紹
- 中文名:核外運信號
- 外文名:nuclear export signal NES
- 功能:參與生物大分子運出核孔的過程
基本信息,核轉運過程,NES的調控,NES資料庫,
基本信息
NES信號首先在HIV-1的Rev蛋白和cAMP依賴性蛋白激酶抑制劑(cAMP-dependent protein kinase inhibitor,PKI)上發現。NES片段會被核轉運蛋白識別並結合。通過計算機的分析發現,NES的疏水區域最常見的胺基酸序列為LXXXLXXLXL,其中L是疏水殘基(通常為亮氨酸),X是其他的胺基酸。這些胺基酸殘基的空間排布可以由那些包含NES的蛋白結構來解釋,通常來說,那些關鍵的殘基通常在蛋白二級結構的同一個面上,這樣使得它們能和核轉運蛋白共同相互作用。核糖核酸(RNA)上沒有核外運信號,因此大多數RNA的出核運輸需要提前與蛋白結合形成核糖核蛋白複合體然後運出。

核外運信號
核轉運過程
核外運過程從Ran-GTP(一種G蛋白)與核轉運蛋白結合開始。核轉運蛋白因結合Ran-GTP而處於激活狀態,蛋白的構象改變,增加了它與目標蛋白的親和力。當待轉運蛋白結合上後,形成的Ran-核轉運蛋白-目標蛋白複合體從核孔穿過核膜。在核膜外,GTP酶活化蛋白(GTPase activating protein,GAPs)將Ran上的GTP水解成GDP,這一變化直接導致了核轉運蛋白的失活,Ran-GDP從核轉運蛋白上釋放。目標分子與核轉運蛋白的親和力也隨之降低,複合物分離。這就完成了目標蛋白從核內到核外穿核孔的運輸。
在核外Ran-GDP會在鳥氨酸轉移因子(guanine exchange factor,GEF)的作用下再次變成Ran-GTP, 並於核轉運因子,另一種進核蛋白結合形成複合物進入核內,往復循環。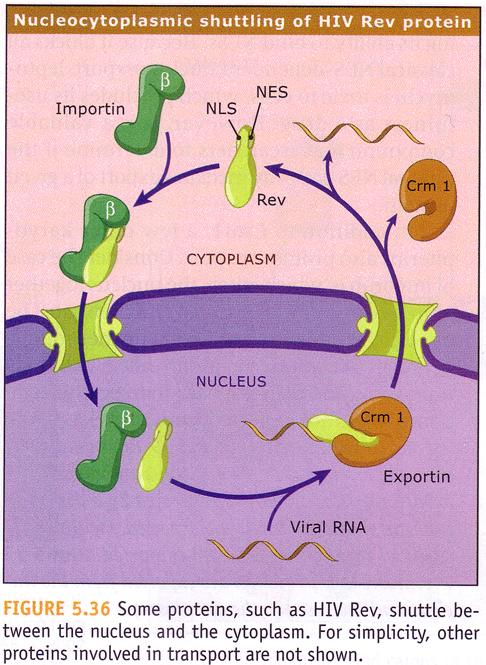

核外運信號
NES的調控
HIV-1病毒的Rev蛋白的核轉運蛋白受體CRM1已被證實在多種細胞內是一種進化上保守的NES識別受體。由CRM1介導的核外運過程可以被出核轉運抑制劑萊普黴素B(leptomycin B)高效的抑制,這為在實驗上驗證這類通路提供了相當好的工具。
通過抑制NES信號,另一些具有其他功能的蛋白的出核轉運也在實驗上發現被抑制了。比如細胞骨架中的肌動蛋白,其功能主要是協助細胞運動和成長;還有在酵母中發現的激酶Dsk1,出核膜過程也會被LBM抑制。用LBM抑制NES功能後成功的發現了肌動蛋白在核內聚集,從而說明NES在大量的蛋白實現功能的過程中發揮著作用。
不是所有NES的底物都是組合成一個複合物從細胞核中運出的,這意味著由CRM1介導的出核通路是一個受調控的過程。有幾種NES依賴出核通路的調控方式被發現,包括遮蔽/顯示NES,磷酸化,以及氧化形成二硫鍵。
NES與蛋白質的輸出受體的結合的形式決定了NES通路對胺基酸序列的特異性。對蛋白質的特定NES胺基酸序列的研究顯示了用該胺基酸序列的抑制劑阻斷該蛋白質NES活化的可能性,而核內其他蛋白則不受影響。
NES資料庫
NESbase是蛋白質的資料庫,裡面有實驗上已經證實的富含亮氨酸的NES。丹麥技術大學生物序列分析中心和哥本哈根大學蛋白質化學系共同驗證了NESbase 1.0版。每一條數據包括了NES是否能有效地外運,或是只在CRM1介導下運作。
