化合物簡介,基本信息,物化性質,安全信息,計算化學數據,合成方法,用途,藥典標準,分子式與分子量,來源(名稱)、含量(效價),性狀,鑑別,檢查,含量測定,藥理作用:,毒理研究:,藥代動力學:,適應症:,用法用量:,新診斷的多形性膠質母細胞瘤的成人患者:,禁忌:,不良反應,膠質瘤復發或進展的成人患者,注意事項,新診斷多形性膠質母細胞瘤的患者:,孕婦及哺乳期婦女用藥:,兒童用藥:,老年用藥:,藥物相互作用:,藥物過量:,專家點評,臨床試驗:,國外臨床試驗:,國內臨床試驗,
化合物簡介
基本信息
中文名稱:替莫唑胺
中文別名:3-甲基-4-氧代-8-咪唑並[5,1-d][1,2,3,5]四嗪甲醯胺;8-氨基甲醯基-3-甲基咪唑[5,1-d]並-1,2,3,5-四氮嗪-4-(3H)-酮;4-甲基-5-氧代-2,3,4,6,8-五氮雜雙環[4.3.0]壬基-2,7,9-三烯-9-甲醯胺;3,4-二氫-3-甲基-4-氧代咪唑並[5,1-d]-1,2,3,5-四嗪-8-甲醯胺;8-氨甲醯-3-甲基咪唑[5,1-d]-1,2,3,5-四嗪-4(3H)-酮;替目唑胺;4-甲基-5-氧代-2,3,4,6,8-五氮雜雙環[4.3.0]壬-2,7,9-三烯-9-甲醯胺;
英文名稱:Temozolomide
英文別名:temodar;TZM;Temozolamide;temosolomide;
CAS號:85622-93-1
MDL號:MFCD00866492
RTECS號:NJ5927050
分子式:C6H6N6O2
結構式:

分子量:194.15100
精確質量:194.05500
PSA:108.17000
物化性質
外觀與性狀:灰白色至淡粉紅色結晶固體
密度:1.97 g/cm3
熔點:212°C dec.
沸點:526.6ºC at 760 mmHg
閃點:272.3ºC
儲存條件:2-8ºC
安全信息
符號:GHS07;GHS08
信號詞:危險
危害聲明:H302; H315; H319; H335; H350; H360
警示性聲明:P201; P261; P305 + P351 + P338; P308 + P313
海關編碼:2933990090
危險類別碼:R45
安全說明:S24/25; S45; S36/37; S26; S53
RTECS號:NJ5927050
危險品標誌:T; Xi
計算化學數據
1.疏水參數計算參考值(XlogP):無
2.氫鍵供體數量:1
3.氫鍵受體數量:5
4.可旋轉化學鍵數量:1
5.互變異構體數量:2
6.拓撲分子極性表面積106
7.重原子數量:14
8.表面電荷:0
9.複雜度:315
10.同位素原子數量:0
11.確定原子立構中心數量:0
12.不確定原子立構中心數量:0
13.確定化學鍵立構中心數量:0
14.不確定化學鍵立構中心數量:0
15.共價鍵單元數量:1
合成方法
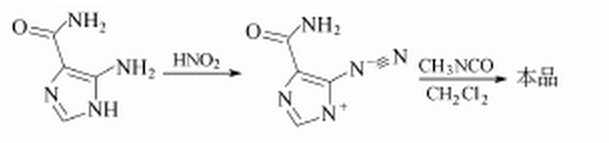
1. 5-氨基-4-甲醯胺基咪唑經亞硝酸重氮化後,再和異氰酸甲酯在二氯甲烷中反應,環合得到替莫唑銨。
2. 5-氨基咪唑-4-羧醯胺鹽酸鹽的製備
在反應瓶中加入工業的2-脒基-2-甲醯氨基乙醯胺鹽酸鹽47.4g(0.2mol)和二甲苯150ml,油浴攪拌加熱至回流(開始約130~140 ºC,以後慢慢降至118~120 ºC,保溫回流3h. 趁熱濾出二甲苯,用新鮮二甲苯60ml洗結晶,並減壓濃縮至乾,加無水乙醇100ml,洗滌,冷卻,析晶, 過濾,濾餅抽乾後於50 ºC以下減壓乾燥,得5-氨基咪唑-4-羧醯胺鹽酸鹽27.9g,收率85.8%.
3. 5-氨基-咪唑-4-羧醯胺(一水合物)的製備
在反應瓶中加入5-氨基咪唑-4-羧醯胺鹽酸鹽27.9g(0.170mol)和去離子水50ml,攪拌微熱溶解,於30 ºC下滴加NaOH(10%水溶液) 至pH7左右, 加入保險粉,(Na2S2O4) 適量, 冰凍放置過夜,過濾,用少量冰水洗濾餅,60 ºC真空乾燥,得5-氨基-咪唑-4-羧醯胺(一水合物)23.6g,收率95%,mp174~176 ºC.
4. 5-重氮咪唑-4-羧醯胺的製備
恆壓滴液漏斗中加5-氨基-咪唑-4-羧醯胺(一水合物)26g(0.180mol)和1mol/L鹽酸300ml的混合液,於0~5ºC攪拌下緩慢滴加到盛有NaNO220.7g(0.3mol) 與水100ml的反應瓶中, 約30min滴完. 滴畢, 保溫攪拌30min,TLC跟蹤反應[展開劑: 甲醇/乙酸乙酯(體積比2:3)]. 到反應終點後, 減壓濃縮至有少量晶體出現, 冷卻, 析晶, 抽濾, 少量水洗濾餅,40 ºC減壓乾燥得黃色重氮化物結晶5-重氮咪唑-4-羧醯胺5-重氮咪唑-4-羧醯胺22.4g, 收率71%.mp205~208ºC.
5. 替莫唑胺的合成
在反應瓶中加入5-重氮咪唑-4-羧醯胺22g(0.125mol)、異氰酸甲酯43ml(41.27g,0.724mol)和乙酸乙酯/DMF(體積比3:1)混合液100ml,於室溫(25~30 ºC)避光攪拌反應40h,過濾,濾餅用乙酸乙酯洗滌,低溫減壓乾燥得替莫唑胺粗品24.1g,收率99%.將粗品24g用丙酮/水(體積比3:2)100ml溶解混合,再入活性炭少許,加熱回流20~25min,熱過濾,濾液冷卻析晶,得精製品替莫唑胺19.4g,收率80%,mp210~213 ºC.
用途
抗腫瘤藥。在體內可自發和很快地降解產生活性代謝物MTIC,而產生抗腫瘤作用。用作成人惡性神經膠質瘤和惡性黑色素瘤的治療藥物。
本品為抗腫瘤藥.在體內可自發和很快地降解產生活性代謝物MTIC,而產生抗腫瘤作用.本品是烷化劑抗腫瘤藥中的氮烯咪唑類,是咪托唑胺類似物,它是在臨床上治療腦部腫瘤最有效的藥物之一.研究表明,對各種動物實驗腫瘤有明顯療效,包括TLX5淋巴瘤,口服本品對經皮下移植在無胸腺小鼠的腦瘤有明顯療效.它能通過血腦屏障,臨床上治療腦或鞘內瘤和晚期黑色素瘤腦轉移,以及成人頑固性多形性成膠質細胞瘤等.其毒副作用小,耐受性好.
藥典標準
分子式與分子量
C6H6N6O2 194.15
來源(名稱)、含量(效價)
本品為3,4-二氫-3-甲基-4氧代咪唑[5,1-d]並1,2,3,5-四嗪-8-甲醯胺。按乾燥品計算,含C6H6N6O2應為98.0%~102.0%。
性狀
本品為白色至微紅色粉末;無臭。
本品在二甲基亞碸中略溶,在水中微溶,在甲醇中極微溶解,在乙醇中幾乎不溶,在冰醋酸中微溶。
鑑別
(1)取本品,加冰醋酸溶液(5→1000)定量稀釋製成每1ml中約含10μg的溶液,照紫外-可見分光光度法(2010年版藥典二部附錄ⅣA)測定,在254nm與330nm的波長處有最大吸收,在240nm與279nm的波長處有最小吸收。
(2)在含量測定項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。
(3)本品的紅外光吸收圖譜應與對照的圖譜(《藥品紅外光譜集》1216圖)一致。
檢查
有關物質
取本品,加流動相溶解並稀釋製成每1ml中含1.0mg的溶液,作為供試品溶液;另取4-氨基-5-氨基甲醯基咪唑一水合物對照品適量,加流動相溶解並稀釋製成每1ml中含1.0mg的溶液,作為對照品溶液;精密量取供試品溶液與對照品溶液各1ml,置同一200ml量瓶中,用流動相稀釋至刻度,搖勻,作為對照溶液。照含量測定項下的色譜條件,取對照溶液20μl注入液相色譜儀,出峰順序依次為:4-氨基-5-氨基甲醯基咪唑與替莫唑胺。調節檢測靈敏度,使替莫唑胺色譜峰的峰高約為滿量程的10%。再精密量取供試品溶液與對照溶液各20μl,分別注入液相色譜儀,記錄色譜圖至替莫唑胺峰保留時間的2.5倍。供試品溶液的色譜圖中如有4-氨基-5-氨基甲醯基咪唑峰,其峰面積不得大於對照溶液替莫唑胺峰面積(0.5%)}其他單個雜質峰面積不得大於對照溶液替莫唑胺峰面積(0.5%);各雜質峰面積的和不得大於對照溶液替莫唑胺峰面積的2倍(1.0%)。
二甲基亞碸
精密稱取二甲基亞碸25mg,置100ml量瓶中,用N,N-二甲基甲醯胺稀釋至刻度,搖勻,精密量取5ml,置10ml量瓶中,精密加內標溶液(取N-甲基吡咯烷酮適量,加N,N-二甲基甲醯胺製成每1ml中約含1mg的溶液)1ml,用N,N-二甲基甲醯胺稀釋至刻度,搖勻,作為對照品溶液;另取本品0.25g,精密稱定,置10ml量瓶中,精密加入內標溶液1ml,用N,N-二甲基甲醯胺稀釋至刻度,搖勻,作為供試品溶液。照殘留溶劑測定法(2010年版藥典二部附錄ⅧP 第三法)試驗。以聚乙二醇為固定液;柱溫200℃,檢測器溫度為240℃。精密量取供試品溶液和對照品溶液各1μl,分別注入氣相色譜儀,記錄色譜圖。按內標法以峰面積計算,應符合規定。
乾燥失重
取本品1.0g,置五氧化二磷乾燥器中,在60℃減壓乾燥至恆重,減失重量不得過0.5%(2010年版藥典二部附錄Ⅷ L)。
熾灼殘渣
取本品1.0Og,依法檢查(2010年版藥典二部附錄Ⅷ N),遺留殘渣不得過0.1%。
重金屬
取熾灼殘渣項下遺留殘渣,依法檢查(2010年版藥典二部附錄ⅧH 第二法),含重金屬不得過百萬分之十。
含量測定
照高效液相色譜法(2010年版藥典二部附錄ⅤD)測定。
色譜條件與系統適用性試驗
用十八烷基矽烷鍵合矽膠為填充劑;以甲醇-0.5%冰醋酸溶液(10:90)為流動相}檢測波長為254nm。理論板數按替莫唑胺峰計算不低於9000,替莫唑胺峰與相鄰雜質峰的分離度應符合要求。
測定法
取本品適量,精密稱定,加流動相溶解並定量稀釋成每1ml中約含替莫唑胺0.1mg的溶液,精密量取20μl注入液相色譜儀,記錄色譜圖;另取替莫唑胺對照品,同法測定。按外標法以峰面積計算,即得。
藥理作用:
替莫唑胺為咪唑並四嗪類具有抗腫瘤活性的烷化劑。在體循環生理pH狀態下,迅速轉化為活性產物MTIC (3-甲基-(三嗪-1-)咪唑-4-甲醯胺)。MTIC的細胞毒作用主要表現為DNA分子上鳥嘌呤第6位氧原子上的烷基化以及第7位氮原子的烷基化。通過甲基化加成物的錯配修復,發揮細胞毒作用。
毒理研究:
在小鼠、大鼠和犬進行了本品單劑量毒性研究。大鼠口服的LD50約為1900mg/m,比小鼠高(約1000mg/m)。對犬的最小致死劑量為600mg/m。在單劑量研究中,毒性的臨床體徵和死亡一般出現都較遲,顯示其對導致器官功能損害增生迅速的組織具有遲發性毒性作用;毒性作用符合烷化劑的預期毒性。
口服本品後被迅速吸收,並很快排泄到尿中。人治療劑量的暴露程度與大鼠和犬的相似。業已進行了3個周期和6個周期的大鼠和犬的毒性研究,一個周期為給藥5天,停藥23天。在多周期研究中,主要毒性靶器官是骨髓、淋巴網狀系統,睪丸和胃腸道。本品對大鼠和犬的毒性比對人較大。人對治療劑量(200mg/m)能很好耐受,但該劑量接近大鼠和犬多劑量的最低致死劑量。白細胞和血小板與劑量相關的減少是大鼠和犬的敏感指標。在治療間期,大多數血液學和生化指標以及和組織病理改變能明顯恢復。在6個周期大鼠研究中考察的瘤譜包括乳腺癌、皮膚角化棘皮瘤、基底細胞腺瘤和各種間質瘤。犬研究中未考察腫瘤或癌前變化。考慮到本品是烷化劑MTIC的前體藥物,預期具有致瘤的作用,這在其他烷化劑(包括產生MTIC的)中已觀察到。本品對大鼠的致瘤作用似乎是物種特異的,與其他化療藥物無明顯差異。
本品Ames/沙門氏菌和HPBL試驗中顯示有致突變作用,並在人外周淋巴細胞測定中能引起染色體畸變。
藥代動力學:
臨床前數據提示本品能迅速通過血腦屏障,進入腦脊液。成年患者口服本品後,被迅速吸收,最早在服藥後20分鐘就可達到血藥峰濃度(平均時間為0.5-1.5小時)。血漿清除率、分布容積和半衰期都與劑量無關。本品的蛋白結合率低 (10% -20%),因此估計不會與蛋白結合率高的藥物發生相互作用。口服C-本品後7天內糞便內排泄的C 為0.8%,表明藥物是完全吸收的。口服後,24小時尿內的原形藥占劑量的5%-10%左右,其餘是以AIC(4-氨基-5-咪唑-鹽酸羧醯胺)形式或其他極性代謝物排泄到尿中。
本品藥代動力學的群體分析表明本品血漿清除率與年齡、腎功能或吸菸無關。
兒科患者的AUC比成人患者高,但是兒童和成人每周期的最大耐受劑量(MTD) 都是1000 mg/m。
適應症:
本品用於治療:
- 新診斷的多形性膠質母細胞瘤,開始先與放療聯治療,隨後作為輔助治療。
- 常規治療後復發或進展的多形性膠質母細胞瘤或間變性星形細胞瘤。
用法用量:
新診斷的多形性膠質母細胞瘤的成人患者:
同步放化療期:口服本品,每日劑量為75mg/m,共42天,同時接受放療(60 Gy 分30次);隨後接受6個周期的本品輔助治療。根據患者耐受程度可暫停用藥,但無需降低劑量。同步放化療期如果符合以下條件:絕對白細胞計數≥1.5×10/L,血小板計數≥1.5×10/L,普通毒性標準(CTC)-非血液學毒性≤1級(除外脫髮、噁心和嘔吐),本品可連續使用42天,直至49天。治療期間每周應進行全血細胞計數。在同步化療期間應按血液學和非血液學毒性標準(表1)暫停或終止服用本品。
如果符合以下標準,繼續可以與TMZ同時治療:絕對白細胞計數≥1.5*10/L,血小板計數≥1.5*10/L,CTC-非血液學毒性≤1級(脫髮、噁心和嘔吐除外)
TMZ=本品;CTC=普通毒性標準
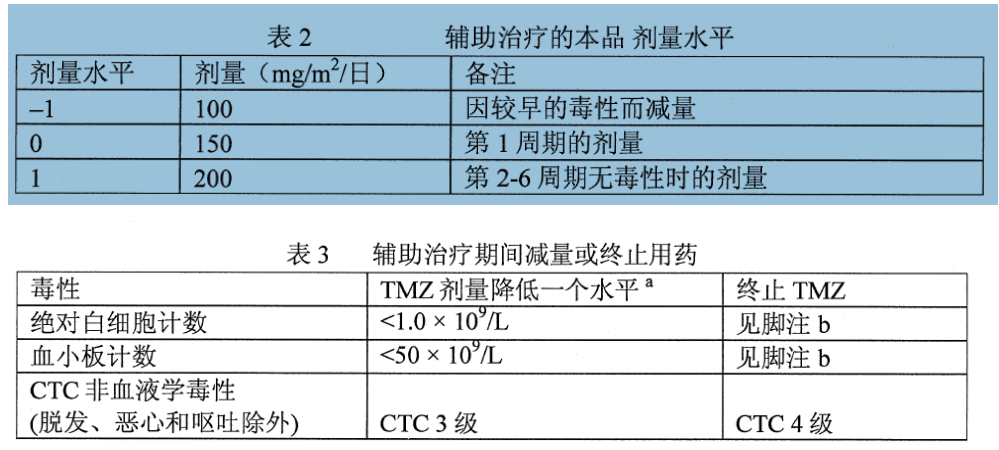
輔助治療期:本品同步放化療期結束後4周,進行6個周期的本品輔助治療。第1周期的本品劑量是150mg/m/日,每日一次,共5天,然後停藥23天。第2周期開始時,如果第1周期CTC的非血液學毒性≤2級(除外脫髮、噁心和嘔吐)、絕對白細胞計數(ANC)≥1.5 ×10/L和血小板計數≥100×10/L,則劑量可增至200mg/m/日。如果第2周期的劑量沒有增加,在以後的周期中也不應增加劑量。除出現毒性外,以後各周期的劑量維持在每日200mg/m。輔助治療期間應按表2和表3降低劑量。
治療期間,第22天(首劑本品後21天)應進行全血細胞的計數。應按表3降低劑量或終止服用本品。
a: TMZ劑量水平見表2。
b: 如果需要將TMZ降至<100mg/m,或如果降低劑量後重新出現同樣的3級非血液學毒性(脫髮、噁心和嘔吐除外),則應終止TMZ治療。
TMZ=本品;CTC=普通毒性標準
常規治療後復發或進展的多形性膠質母細胞瘤或間變性星形細胞瘤患者:
成人患者:以前曾接受過化療患者的本品起始劑量是150 mg/m/日,共5天.如果下個周期第一天的ANC≥1.5×10/L 和血小板計數≥100×10/L,則第2周期的劑量增為200 mg/m/日。應根據ANC和血小板計數最低值調整本品的劑量。
兒童患者:在以前曾接受過化療3歲或3歲以上的患兒中,每28天周期中本品口服起始劑量是150 mg/m/日,共5天; 如果沒有出現毒性,下個周期的劑量增至200 mg/m/日。
治療可繼續到病變出現進展,最多為2年。
調整劑量的實驗室參數
必須符合以下實驗室參數才能用藥:ANC≥1.5×10/L 和血小板計數≥100×10/L。第22天(首劑後21天)或該天48小時內以及每周必須檢查全血細胞的計數,直至ANC≥1.5×10/L 和血小板計數≥100×10/L。如果任何一個周期內的ANC<1.0×10/L 或血小板計數<50×10/L,下個周期的劑量必須降低一個水平。劑量水平包括100 mg/m、150 mg/m和200 mg/m。推薦的最低劑量為100 mg/m。
全部患者:應空腹(進餐前至少一小時)服用本品。服用本品前後可使用止吐藥。如果服藥後出現嘔吐,當天不能服用第2劑。
不能打開或咀嚼本品,套用一杯水整粒吞服。如果膠囊有破損,應避免皮膚或黏膜與膠囊內粉狀內容物接觸。
禁忌:
對替莫唑胺膠囊或達卡巴嗪(DTIC)過敏者禁用。
妊娠期禁用(見孕婦及哺乳期婦女用藥)
禁用於嚴重骨髓抑制的患者。
不良反應
本品主要的不良反應包括噁心、嘔吐、倦怠和血液學反應。噁心、嘔吐、頭痛和倦怠的發生頻率最高。這些不良反應通常為NCI通用毒性標準(NCIcommon toxicity criteria,CTC)1或2級(輕至中度),且為自限性,用止吐藥即可控制噁心和嘔吐。重度噁心和嘔吐(CTC3或4級)的發病率分別為10%和6%。 骨髓抑制為劑量限制性不良反應,通常在治療的第一個周期發生,不累積。
膠質瘤復發或進展的成人患者
臨床試驗中,最多發生的不良反應是胃腸道功能紊亂,特別是噁心(43%)和嘔吐(36%);一般為1級或2級(輕中度),具有自限性,或標準止吐藥易於控制。重度噁心和嘔吐發生率為4%。
其他經常報告的不良事件包括疲乏(22%)、便秘(17%)和頭痛(14%)。還報告食慾減退(11%)、腹瀉(8%),皮疹、發熱、無力和瞌睡發生率各為6%。不常見的(2%-5%)不良事件按發生率的遞減次序為腹痛、疼痛、頭暈、體重下降、不適、呼吸困難、脫髮、僵直、瘙癢、消化不良、味覺異常,感覺異常和瘀點。
實驗室結果:膠質瘤患者的3級或4級血小板減少和中性白細胞減少的發生率分別為19%和17%。有8%和4%膠質瘤患者因此而住院和/或停止本品治療。骨髓抑制是可以預見的(一般在開始幾個周期的第21-28天), 通常在1-2周內迅速恢復。未發現有累積的骨髓抑制。還報告全血細胞減少、白細胞減少和貧血;淋巴細胞減少也很常見。
對臨床試驗中藥代動力學人群進行的分析顯示,達到中性粒細胞最低值的人數,女性101例,男性169例; 血小板達到最低值人數,女性110例,男性174例。治療的第一周期4級不良反應發生率女性高於男性,其中中性粒細胞減少(ANC <500 cells/μL)女性12%,男性5%;血小板減少(<20,000 cells/μL)女性9%,男性3%。在一組400例復發性神經膠質瘤受試者的數據中,治療的第一周期的4級中性粒細胞減少發生率,女性與男性分別為8%和4%;而4級血小板減少的發生率則分別為8%和3%。在另一個有288例受試者參加的、新近診斷的多行性成膠質細胞瘤試驗中,治療第一周期的4級中性粒細胞減少發生率,女性與男性分別為3%和0%;4級血小板減少發生率則分別為1%和0%。
本品上市期間,很少有機會性感染病例的報告,包括卡氏肺囊蟲性肺炎。極少報告多形性紅斑、中毒性表皮壞死、斯-約二氏綜合症和變態反應(包括過敏反應)病例。在接受本品治療患者中報告過骨髓增生異常綜合徵(MDS)和繼發的惡性疾病(包括髓細胞性白血病)的罕見病例。有見報導可導致再生障礙性貧血的全血細胞減少的報告,並且在一些病例出現了致命的後果。曾報導過的肝臟毒性病例包括肝酶升高、高膽紅素血症、膽汁淤積及肝炎。
在中國進行的臨床研究中未出現非預期的不良事件,總體結果與國外報導的數據相似。
注意事項
在一項治療時間延長到42天的小規模試驗中,接受本品和放療合併治療的患者是卡氏肺囊蟲性肺炎的高危者。因此對於接受42天(最多為49天)合併治療的全部患者需要預防卡氏肺囊蟲性肺炎發生。
在較長期的給藥方案治療期間,接受替莫唑胺治療期間卡氏肺囊蟲性肺炎發生率可能較高。不管何種治療方案,都應密切觀察替莫唑胺治療的全部患者(特別是接受類固醇治療患者)發生卡氏肺囊蟲性肺炎的可能性。
止吐治療:噁心和嘔吐常與本品相關,服用本品前後可使用止吐藥。指導原則為:
新診斷多形性膠質母細胞瘤的患者:
- 在開始接受替莫唑胺合併治療前,建議採用止吐藥預防,
- 在輔助治療期間,極力建議採用止吐藥預防。
神經膠質瘤復發或進展的患者:在以前治療周期中出現過重度(3或4級)嘔吐的患者需要止吐藥治療。
接受替莫唑胺治療的患者可能會出現骨髓抑制,包括持續的全血細胞降低,可能導致再生障礙貧血,且在一些病例中導致了致命的結果。在一些病例中,如同時服用其他與再生障礙貧血有關的藥物(包括卡馬西平、苯妥英、複方磺胺甲惡唑),會使評估更為困難。
男性患者:服用替莫唑胺的男性患者應採取有效的避孕措施。替莫唑胺具有遺傳毒性,因此在治療過程及治療結束後6個月之內,男性應避孕。由於接受替莫唑胺治療有導致不可逆不育的可能,在接受該治療之前應冰凍保存精子。
肝腎功能損害者:肝功能正常的病人與肝功能輕中度異常的病人藥代動力學結果相似;嚴重肝功能異常(Child’s Class III)或腎功能異常的患者尚無服用替莫唑胺的資料。根據替莫唑胺膠囊藥代動力學特徵,對於嚴重肝腎功能不全的病人不必降低替莫唑胺用量,但套用時需倍加小心。
孕婦及哺乳期婦女用藥:
對妊娠期婦女使用該藥尚未進行研究。在用大鼠和兔所進行的臨床前研究中,給藥150mg/m曾有致畸和/或胎兒毒性的報導。因此替莫唑胺不應常規用於妊娠期婦女,如果妊娠期內必須使用該藥,應將可能對胎兒造成的潛在風險告知病人。對於可能懷孕的婦女,應勸阻其在接受替莫唑胺治療或在終止替莫唑胺治療後6個月內懷孕。
替莫唑胺是否可經母乳分泌尚不可知,因此替莫唑胺膠囊不套用於哺乳期婦女。
兒童用藥:
尚無3歲以下多形性膠質母細胞瘤患兒使用該藥的臨床經驗;對於3歲以上膠質瘤兒童患者,使用該藥的臨床經驗有限。
老年用藥:
與年輕患者相比,老年患者(>70歲)中性粒細胞減少及血小板減少的可能性較大。
藥物相互作用:
同時服用雷尼替丁或食物對替莫唑胺膠囊吸收程度的影響無臨床意義。同時服用地塞米松、丙氯拉嗪、苯妥英、卡馬西平、昂丹司瓊、H2受體拮抗劑或苯巴比妥等,不影響替莫唑胺的清除。同時服用丙戊酸,替莫唑胺清除率輕度降低(有統計學意義)。
替莫唑胺膠囊與其他可導致骨髓抑制的的藥物聯合套用時,骨髓抑制可能加重。
藥物過量:
在患者中已進行了劑量為500、750、1000和1250mg/m(每治療周期服藥5天的總劑量)的臨床評價。劑量限制性毒性為血液學毒性,在任一劑量下均有報導,但在較高劑量時較為嚴重。一患者5天中每天過量服用2000mg,所報導的不良事件為全血細胞減少症、發熱、多器官衰竭及死亡。在服藥超過5天(最長達64天)的患者中所發生的不良事件包括骨髓抑制(伴隨或不伴隨感染),某些嚴重且持久的病例最終死亡。在藥物過量事件中,應進行血液學評價。必要時應採取支持性措施。
專家點評
在對162例第一次復發多形性成膠質細胞瘤的患者進行了一項多中心研究,其中54例為頑固性多形性成膠質細胞瘤(即使用包含亞硝基脲和甲基苄肼的化療方案時病情惡化)。該人群的總體腫瘤反應率(CR+PR)為22%,完全反應率為9%。所有反應平均維持50周(16~114周),完全反應平均維持64周(52~114周)。在此人群中,6個月時無惡化存活率為45%(95%可信區間為31%~58%);12個月時無惡化存活率為29%(95%可信區間16%~42%);平均無惡化存活期為4.4個月。6個月時總體存活率為74%(95%可信區間為62%~86%);12個月時總體存活率為65%(95%可信區間為52%~78%);平均總體存活期為15.9個月。
臨床試驗:
國外臨床試驗:
新診斷的多形性膠質母細胞瘤:573例患者隨機接受替莫唑胺+局部放療(n=287)或單一放療(n=286)。替莫唑胺+局部放療組患者在放療首日開始服用替莫唑胺75mg/m,每日一次,共42天(最多為49天)。隨後在放療結束後4周開始替莫唑胺輔助治療:28天一個周期,每周期的第1-5天服藥,每日150 -200mg/m,共6個周期。對照組患者僅接受放療。放療和與替莫唑胺聯合治療期間需要預防卡氏肺囊蟲性肺炎(PCP),並持續到淋巴細胞減少恢復到<1度。
隨訪期間,282例僅接受放療的患者中有161例(57 %) 以及277例替莫唑胺+放療的患者中有62例(22%) 都再次接受了替莫唑胺的治療。
總生存的風險比(HR)為1.59 (95% CI為1.33-1.91),時序檢驗p<0.0001,有利於替莫唑胺組。替莫唑胺+放療組2年生存率較對照組高(26%對10%)。新診斷的多形性膠質母細胞瘤患者採用同步放化療加替莫唑胺輔助治療後,總生存時間與單獨放療相比有明顯提高,並有統計學意義。(圖1)
圖1 總生存時間的Kaplan-Meier曲線(意向性治療人群,ITT)
常規治療後復發或病變進展的惡性膠質瘤
手術或放療後復發或病變進展的多形性膠質母細胞瘤患者(Karnofsky體力狀態評分≥70)的臨床有效性數據是來自兩項臨床試驗。一項是在138例患者(29%患者曾接受過化療)中進行的無對照試驗;另一項是在225 例(67%患者曾接受過以亞硝脲類為主的化療)中進行的替莫唑胺與丙卡巴肼(甲基苄肼)的隨機、對照試驗。這二項試驗的主要終點為無進展生存時間(PFS),以MRI掃描或神經系統症狀惡化情況進行判斷。在無對照的試驗中,6個月的PFS 為19%。中位PFS為2.1月,中位總生存時間為5.4月。MRI掃描的客觀緩解率為8%。
隨機、對照研究中,替莫唑胺組的6個月的無進展生存PFS明顯高於丙卡巴肼組(21%對8%,卡方檢驗p=0.008), 中位PFS分別為2.89月和1.88月(時序檢驗p=0.0063)。替莫唑胺組和丙卡巴肼組的中位生存時間分別為7.34 月和5.66月(時序檢驗p=0.33)。6個月時,替莫唑胺組患者存活的比例明顯高於丙卡巴肼組,分別為60%和44%,卡方檢驗p=0.019。以前接受過化療患者的Karnofsky體力狀態有改善,可達到80或以上。
與體力狀態惡化(KPS評分保持在60以上或至少降低30)的時間相同,神經系統症狀惡化時間的數據,替莫唑胺組也優於丙卡巴肼組。對於這些終點的中位進展時間,替莫唑胺組比丙卡巴肼組長0.7-2.1月(時序檢驗p≤0.01-0.03)。
間變性星形細胞瘤
一項全球多中心的前瞻性、非隨機的II期試驗,評價了口服替莫唑胺治療首次復發間變性星形細胞瘤患者的安全性和有效性,46%患者的無進展生存時間達到6個月。中位無進展生存時間為5.4月。中位總生存時間為14.6月。根據對ITT人群的集中評價,緩解率為35%,13例CR 和43例PR。包括43例持續病變緩解,緩解率為61%。ITT人群中有6個月無事件生存時間達到44%,中位無事件生存時間為4.6月,與無進展生存時間相似。對於適合組織學檢查的人群,有效性結果也相似。患者達到放射學客觀緩解或維持無進展狀態時,能提高和保持其生活質量。
國內臨床試驗
2005年在中國進行的臨床試驗為多中心、開放、隨機、陽性藥平行對照的試驗。比較替莫唑胺和司莫司汀治療經常規治療後復發或進展的膠質母細胞瘤或間變性星形細胞瘤的療效和安全性的研究。本研究共入選受試者144例,替莫唑胺組79例,司莫司汀組65例。替莫唑胺起始劑量150mg/m/天(曾接受過化療者)或200mg/m/天(未接受過化療者),連續5天口服給藥,每28天為一治療周期;司莫司汀起始劑量150mg/m/天,1次頓服,每隔28天給藥1次;兩種藥物治療期均為2~6個月。治療至6月時,替莫唑胺組和對照組的無進展生存率分別為78.29%對55.08%;臨床總緩解率(包括完全緩解和部分緩解)分別為45.83%對21.27%。
試驗表明,替莫唑胺在治療復發性膠質母細胞瘤(GBM)和間變性星形細胞瘤(AA)的療效可能優於司莫司汀。