基本介紹
- 中文名:折點加氯
- 外文名:Chlorination breakpoint
- 定義:一種飲用水消毒方法
- 影響因素:pH值,溫度,接觸時間等
- 學科:環境科學
簡介,基本原理,折點加氯實驗,實驗目的,實驗步驟,注意事項,
簡介
折點加氯為飲用水消毒處理的一種有效方法。當氯投入水中後,先與水中所含的還原性物質(如NO2、Fe、H2S等)反應而被還原為不起消毒作用的氯離子,余氯為零,此時消毒效果不可靠。繼續提高加氯量,氯與氨開始化合,產生氯胺,由於化合性余氯存在而具有一定消毒效果,如再提高加氯量則使氯胺氧化成為不起消毒作用的HCl,水中余氯反而減少直至最低某一折點B(見右圖)。折點B後起所增加的投氯量完全以游離態余氯存在,消毒效果更好。當按大於需氯曲線上所出現的折點的量,加氯消毒處理時稱折點加氯 (見圖中點M)。當水中氨氮等耗氯物質較多時,通常採用該方法。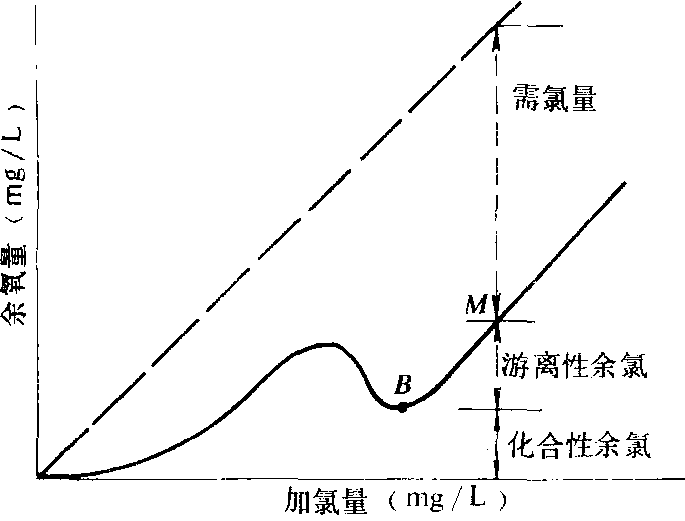 折點加氯圖
折點加氯圖
 折點加氯圖
折點加氯圖基本原理
水中加氯有三個作用:
Cl2+H2O⇌HClO+H++Cl-
HClO⇌H++ClO-
(2)當水中含有氨氮時,加氯後能生成次氯酸和氯胺,它們都有消毒怍用,反應式如下:
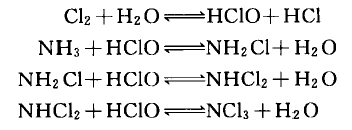 反應方程式
反應方程式次氯酸,氯胺,二氯胺和三氯胺都有可能在水中存在。它們在平衡狀態下的含量比例決定於氨氯的相對濃度,pH值和溫度。當pH=7~8,反應生成物不斷消耗時,1 mol的氯與1 mol的氨作用能生成1 mol的一氯胺,此時氯與氨氮(以N計,下同)的重量比為約為5:1;當pH=7~8,2 mol的氯與1 mol的氨作用能生成1 mol的二氯胺,此時氯與氨氮的重量比約為10:1;當pH=7~8,氯與氨氮重量比大於10:1時,將生成三氯胺(三氯胺很不穩定)和出現游離氯。隨著投氯量的不斷增加,水中游離性氯將越來越多。
折點加氯實驗
實驗目的
(1)掌握折點加氯消毒的實驗技術。
(2)通過實驗,探討某含氨氮水樣與不同氯量接觸一定時間(2 h)的情況下,水中游離性余氯,化合性余氯及總余氯與投氯量的關係。
實驗步驟
(1)水樣製備:取自來水20 L加入1%濃度氨氮溶液2 mL,混勻,即得實驗用水,其氨氮濃度約1 mg/L或略高於1 mg/L。
(2)測原水水溫及氨氮含量,並記錄數據,測氨氮用直接比色法。
(3)進行折點加氯實驗:
① 在12個1000 mL燒杯中各加入水樣1000 mL,並進行編號。
② 當加氯量為l mg、2 mg、4 mg、6 mg、8 mg、10 mg、12 mg、14 mg、16 mg、18 mg、20 mg時,計算1%濃度的漂白粉溶液的投加量(mL)。
③ 在12個盛有1000 mL水樣的燒杯中依次投加1%濃度的漂白粉溶液,其投氯量分別為0 mg/L、1 mg/L、2 mg/L、4 mg/L、6 mg/L、8 mg/L、10 mg/L、12 mg/L、14 mg/L、16 mg/L、18 mg/L及20 mg/L,快速混勻2 h後,立即測各燒杯水樣的游離性余氯、化合性余氯及總余氯的量,並記錄數據。各燒杯水樣余氯測定方法,均採用鄰聯甲苯胺亞砷酸鹽比色法。
注意事項
(1)各水樣加氯的接觸時間應儘可能相同或接近,以利互相比較;
(2)比色測定需在光線均勻的地方或燈光下,不宜在陽光直射下進行;
(3)漂白粉應密閉存放,避免受熱受潮。

