離子化合物(例如氯化鈉)所含的陽離子和陰離子緊密而有規律地排列,形成巨型離子結構。帶相反電荷的離子借著強大的離子鍵連線。
基本介紹
- 中文名:巨型離子結構
- 外文名:giant ionic structrue
定義:離子化合物(例如氯化鈉)所含的陽離子和陰離子緊密而有規律地排列,形成巨型離子結構。
 氯化鈉結構(棍棒模型)
氯化鈉結構(棍棒模型)帶相反電荷的離子借著強大的離子鍵連線。
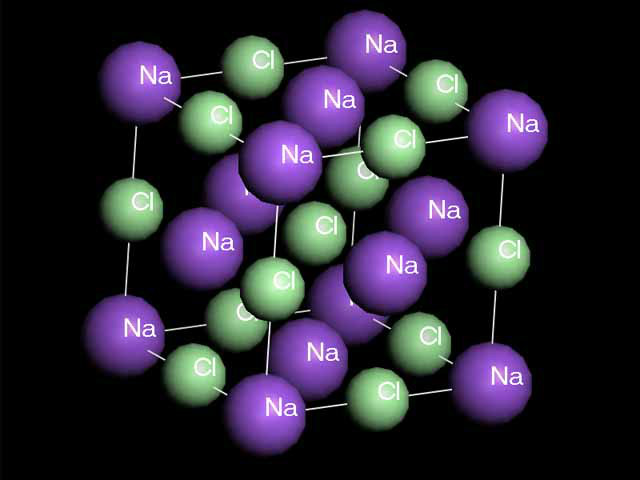
氯化鈉含有鈉離子和氯離子,
這些離子以一個有規律的模式排列,形成晶體。
 氯化鈉(比例模型)
氯化鈉(比例模型)在這晶格中,每個鈉離子被六個氯離子包圍,而每個氯離子也被六個鈉離子包圍。
離子化合物的性質
堅硬和易碎
離子化合物內的離子借著強大的I自薦互相連線,限制了粒子之間相對的移動,所以這類化合物十分堅硬。
離子化合物是易碎的。如果在離子層的方向敲打離子化合物,它們或會裂開。這是因為他們的晶體包含交替的陽離子和陰離子。若按著一定方向敲打會移動該些離子,導致帶相同電荷的離子聚在一起。每層成千上萬個離子之間的排斥會令晶格裂開。
高熔點和沸點
要讓固體離子化合物融化或沸騰,沒必須破壞陽離子和陰離子之間強大的引力(離子鍵),需要大量的熱。因此,;I子化合物具有高熔點、高沸點。所有離子化合物在常溫下是固態。
NaCl和MgO的熔點和沸點
離子化合物 | 氯化鈉 | 氧化鎂 |
化學式 | NaCl | MgO |
熔點(℃) | 808 | 2852 |
沸點(℃) | 1465 | 3600 |
在常溫常壓下的狀態 | 固體 | 固體 |
提示:鎂離子和氧離子所帶的電荷比鈉離子和氯離子所帶的大。此外,和氯化鈉相比,氧化鎂中的離子較小,能較緊密地擠在一起。因此,在氧化鎂中離子之間的靜電引力較強,他的溶沸點因此較高。
溶解度(solubility)
大部分的離子化合物都溶於水,但不溶於非水溶劑。
在水分子中,氧原子的原子核對鍵合電子具有較大的引力,這令分子的氧原子帶有微弱的負電荷,也令氫原子稍微缺少電子,因此帶有微弱的正電荷。
氯化鈉能溶於水,原因是水分子對其離子具有強大的引力。水分子帶負電荷的一端會牽引著鈉離子,帶正電荷的一端則會牽引著氯離子。這些引力令鈉離子和氯離子離開氯化鈉固體,進入水中。
 在水溶液中牽引著的鈉離子和氯離子
在水溶液中牽引著的鈉離子和氯離子氯化鈉中的離子和非水溶劑分子之間沒有這種引力,所以氯化鈉不溶於非水溶劑。