多鍵型晶體例子,多鍵型晶體——矽酸鹽礦物,1、 島狀構造的矽酸鹽,2、環狀構造的矽酸鹽,3、鏈狀構造的矽酸鹽,4、層狀結構的矽酸鹽,5、架狀結構的矽酸鹽,多鍵型晶體的分類,相關拓展,
多鍵型晶體例子
典型的例子如
石墨,見圖右圖。石墨為層狀結構,同層的每個碳原子以sp
2雜化軌道與相鄰的三個碳原子形成σ共價鍵,鍵角為120°,連線成無限的正六邊形的蜂巢狀片層結構,鍵長為142 pm。此外,每個碳原子sp
2雜化後都還有一個垂直於層平面(sp
2雜化平面)的p軌道,每個p軌道上都有一個自旋方向相同的單電子。這些p軌道相互
平行,肩並肩重疊,形成了有多個原子軌道參加的大π鍵。由於大π鍵的形成,這些電子可以在整個石墨晶體的層平面上運動,相當於金屬晶體中的自由電子,這是石墨具有金屬光澤和導電、導熱性的原因。石墨層與層之間的距離遠大於C—C鍵長,達340 pm,它們以分子間力互相結合,這種結合要比同層碳原子間的結合弱得多,所以當石墨晶體受到平行於層結構的外力時,層與層間會發生滑動,這是石墨作為固體潤滑劑的原因。在同一層中的碳原子之間是共價鍵,所以石墨的熔點很高,化學性質很穩定。由此可見,石墨晶體是兼有原子晶體、金屬晶體和分子晶體的特徵,是一種多鍵型晶體。具有多鍵型結構的晶體還有
雲母、
黑磷、六方氮化硼BN(石墨型)等。
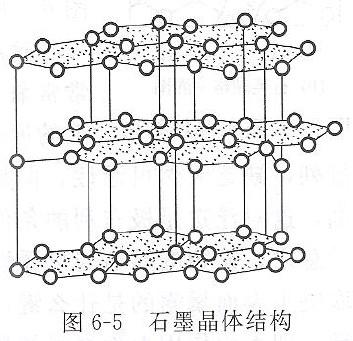 石墨的層狀晶體結構
石墨的層狀晶體結構又如CdI2和CdCI2是許多過渡金屬鹵化物常採取的兩種結構型式。這兩種類型的結構均為層形結構,具有相同結構的層形分子,如圖下圖(a)所示。層型分子的堆積方式不同:Cdl2中垂直於層方向重複的周期為一個層形分子的厚度圖(b)所示,而CdCl2中垂直於層方向重複的周期為三個層形分子的厚度下圖(c)。
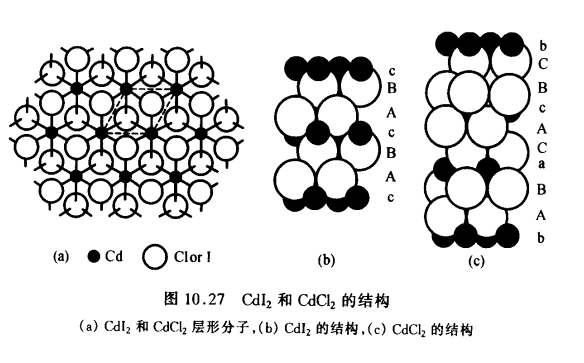 CdI2和CdCl2的結構圖
CdI2和CdCl2的結構圖多鍵型晶體——矽酸鹽礦物
礦物的晶體不只是單一的一種鍵型的晶體,還存在多鍵型晶體-岩石主要由多種矽酸鹽(及矽鋁酸鹽)和石英組成,矽酸鹽種類繁多,結構複雜,它是以矽氧四面體(SiO4)為基本構造單位的。矽與氧之間的鍵是共價鍵,矽氧四面體之間的鍵可能是離子鍵、金屬鍵或分子間力。矽酸鹽礦物可根據其矽氧四面體彼此連結方式不同而加以分類和區別。
1、 島狀構造的矽酸鹽
相鄰矽氧四面體間不共用頂角氧,相互不連線而各自孤立存在,形成孤島狀結構
矽酸鹽,此時絡陰離子團以(SiO
4)
4-形式存在。矽酸鹽中的正離子在孤島狀結構中起雙重行用,既要引入正電荷保證整個結構的電中性,還需起離子鍵合作用把帶負電的絡陰離子團聯繫起來。橄欖石族礦物中的鎂橄欖石(Mg
2(SiO
4))即為典型的孤島狀結構矽酸鹽。
鎂橄欖石晶體的單位晶胞包含四個分子單位,即有四個Si原子、八個Mg原子和十六個O原子。結構中的Mg2+與六個等距離的O2-相結合,把孤立的[SiO4]4-絡陰離子團相互連線起來。從鎂橄欖石晶體結構的空間點陣來看,把氧原子呈近似的六方密堆,在單位晶胞中形成16個八面體空隙和32個四面體空隙.有一半的八面體空隙被Mg2+所占據,而四面體空隙中只有八分之一被占據。Si4+處於四面體空隙中,同時與四個O2-相鍵合,故其配位數為4;Mg2+處於八面體空隙中同時與六個O相鍵合,故其配位數為6;每個O2-同時與三個Mg2+和一個Si4+相鍵合,配位數為4;與每個Si4+的鍵合強度為1,而與每個Mg2+的鍵合強度為六分之二。因此,氧總的鍵合強為1+3X1/3=2,正好使得電價飽和。
在這類結構中,由於是以離子鍵相連線,鍵合力強且在各個方向相差不大,因此這類物質表現出較高的硬度,結構穩定且沒有明顯的解理,如鎂橄欖石為一種高度穩定的矽酸鹽礦物,熔點高達189℃,是鎂質耐火材料中的主要礦物組成。
兩個矽氧四面體共用一頂,即矽氧四面體中只有一個頂角上的氧與其他矽氧四面體共用,則形成聯島狀結構矽酸鹽結構。此時,絡陰離子團以(Si2O7)6-形式存在,其結構單元相當於孤島狀結構矽酸鹽的兩倍,同樣依靠引入的陽離子達到電中性並起離子健作用而聯繫在一起,其表現出來的性質亦與孤島狀結構矽酸鹽相近。矽鈣石Ca3(Si2O7)即為典型的聯島狀結構矽酸鹽。
2、環狀構造的矽酸鹽
矽氧四面體共用兩頂,即矽氧四面體中有兩個頂角上的氧分別與其他矽氧四面體共用,(SiO4)矽氧四面體的連線可在空間不斷延伸,所形成的絡陰離子團結構通式為(SiO3)n 2n-。當由數個矽氧四面體在空間連線成為閉合環,則得到環狀結構矽酸鹽絡陰離子團。典型的環狀結構又分為三節環和六節環,n值分別為8和6,其絡陰離子團為(Si3O9)6-及(Si6O18)12-。環狀結構的絡陰離子團亦依靠引入的陽離子進行連線而得到環狀結構矽酸鹽。在環狀結構矽酸鹽中,藍錐石BaTi(Si3O9)和綠柱石Be3Al2(Si6O18)分別為典型的三節環狀和六節環狀結構。
3、鏈狀構造的矽酸鹽
矽氧四面體共用兩頂,當其連線在一維方向無限延伸,則得到單鏈狀結構的絡陰離子團如下圖(a)所示,單元晶胞n=2,絡陰離子式為(Si2O6)4-,由於該絡陰離子團在一維方向無限延伸,通常將其表示為1∞(Si2O6)4-。此一維方向延伸的矽氧鏈依靠引入的陽離子連線在一起而形成單鏈狀結構矽酸鹽。輝石族礦石中的頑火輝石Mg2(Si2O6)即屬於單鏈狀結構矽酸鹽,鏈間由Mg 2+想聯繫。在Mg2(Si2O6)晶體結構中,(Si2O6)鏈沿c軸無限延伸,鏈與鏈間所形成的空隙被Mg2+填充,每個Mg2+同時與六個氧配位。
在兩個相鄰連線的矽氧四面體中,其中一個四面體有兩個頂角被共用,而另一個四面體有三個頂角被共用,稱為平均共用兩個半頂角,此時矽氧絡陰離子團在一維方向無限延伸,形成雙鏈狀結構絡陰離子團如下圖(b)所示,其絡陰離子式為1∞(Si4O11)6-。單元晶胞中包含四個矽,六個非共用氧和五個共用氧。同樣,雙鏈間的連線也是依靠引入的陽離子來維繫。石棉類礦物角閃石族中的透閃石Ca2Mg5(Si4O11)2(OH)2結構中的雙鏈即是依靠引入的Ca2+、Mg2+與氧間的鍵合將其連線在一起。
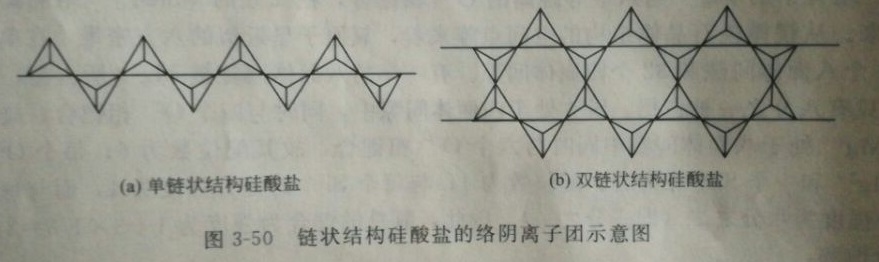 鏈狀結構矽酸鹽的絡陰離子團示意圖
鏈狀結構矽酸鹽的絡陰離子團示意圖4、層狀結構的矽酸鹽
矽氧四面體中有三個頂角鎮分別與其他四面體共用,則得到二維方向無限延伸的矽氧負離子片,用2∞(Si2O5)2-表示。負離子片內是鍵合較強的極性共價鍵,而負離子片間可通過結構中引人的陽離子以離子鍵相連鍵,也可依靠負離子片間的范德華鍵相連線而形成層狀結構矽酸鹽。矽氧層間不同的鍵合形式將會對層狀結構矽酸鹽的性質此時非常大的影響。例如,白雲母結構中,負離子片間由K +結合,層內及層間均為較強的化學鍵合,因而解理會難以進行; 滑石結構中層間依靠范德華鍵結合,層內鍵合強面層間進合弱,易沿著層面發生解理。該類層狀結構材料受外力作用時會沿層面滑動,故在很多場合,如進行單、雙槓器械運動時,滑石等常用作固體潤滑劑。
層狀結構矽酸鹽的種類很多,許多天然無機礦物如黏土類礦物(例如高嶺土Al2 (Si2O5)(OH)4,蒙脫土等)、雲母類礦物(例如白雲母KAl2(AlSi3O10 )(OH,F)2 等)以及滑石(Mg (Si2O5 )2(OH)2) 等都是層狀結構矽酸鹽,均為陶瓷生產中的重要原料。層狀結構矽酸鹽中,為保證晶體結構的電中性,往往會在結構中引入OH 基團及各種正二價或正三價的陽離子。
5、架狀結構的矽酸鹽
矽氧四面體的所有四個頂角氧均分別與其他矽氧四面體共用,則在三維空間形成規則的架狀網路。通常將其表示為3
∞(SiO
2),這即為純品態氧化矽的品體結構,如右圖所示。
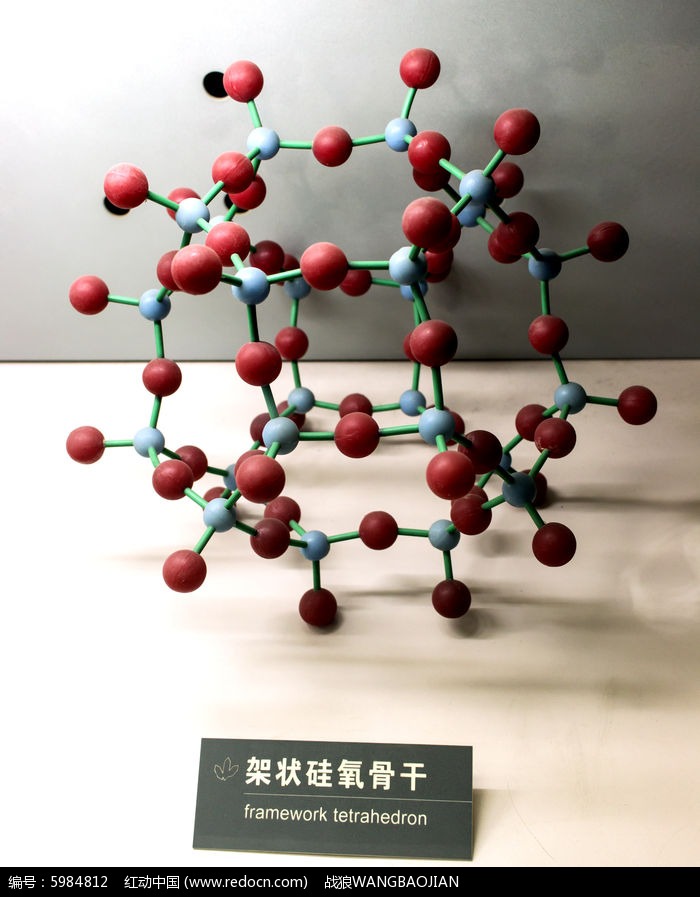 架狀結構
架狀結構二氧化矽在不同的溫度條件和不同的熱歷史具有不同的品型。立方晶系的方石英是其中最簡單的晶型變體,鱗石英和石英是其另外兩種晶型變體。
架狀結構矽酸鹽晶體的(SiO4)中,常有一定數量的Si原子被Al原子置換。這種置換現象只能在兩種原子半徑相差不大時才能發生,置換的結果不影響晶體的結構狀況,稱為同晶置換。
進行同晶置換後的晶體,由於Al 原子與Si原子價鍵的差異,使得一些氧原子產生不飽和的鍵合軌道,晶體結構達不到電中性。為滿足晶體結構的靜電價規則,必須引人鹼金屬原子或其他電正性的原子存在於架狀結構的間隙中,其電子進人尚未飽和的氧原子軌道,使整個晶體達到電中性。
高溫鉀長石 K(AlSi3O8)屬於長石族礦物,其架狀晶體結構構中,有四分之一的矽原子被鋁原子所置。為了保持晶體結構的電中性,每當一個Al 原子取代一個Si 原子,必須同時引人一個K+。其電價除了與網架中(AlO3)的多餘電價中和外,還與網架中的公共氧之間產生誘導鍵鍵合。
多鍵型晶體的分類
如果一化合物存在兩種或兩種以上不同的品體結構形式,則稱該化合物存在多鍵型晶體現象。該現象在自然界中也很普遍,當外界條件變化時,品體結構形式發生改變,碳、矽、金屬的單質、硫化鋅、氧化鐵、二氧化矽以及其他很多物質均有這一現象。例如鐵在906-1401℃溫度範圍內為面心立方結構,而超出這一範圍則為體心立方結構。碳在自然界中存在金剛石和石墨兩種晶型,從熱力學觀點來說,在一定條件下一種是穩定的品型,另一
種是介穩的晶型,存在晶型的變化,但由於變化速度的緩慢,一旦形成以後,可以以地質年代存在於自然界中。
多鍵型晶體可大致分為四類。
(1)不改變配位情況的多鍵型晶體現象 在許多化合物的多晶型晶體中,離子的配位情況基本上不變,但是配位體的連線方式發生改變或是配位多面體發生一定位移。
(2)改變配位情況的多鍵型晶體現象 這類多鍵型晶體現象常發生於金屬鍵和離子鍵型的晶體中。共價鍵晶體的結構不容易改變配位情況。
(3)分子熱運動形成的多鍵型晶體現象 當溫度升高時,晶體中的分子或某些離子團自由旋轉,取得較高的對稱性,而改變晶體的結構。
(4)具有鍵型改變的多鍵型晶體現象 這類多鍵型晶體現象並不常見。白錫和灰錫的轉變是個例子。金剛石和石墨是碳的兩種晶型,由於相互間結合力性質的差異使得晶型間的轉變非常緩慢而且困難。
上述四種多鍵型晶體轉變,總是由於溫度,壓力等外界條件變化時發生的。對於壓力這個因素的影響較單純,當壓力增高時,促使晶體結構往高密度和高配位的方向轉變。而溫度因素的影響比較複雜,一般升高溫度往往配位數下降,而晶體的對稱性提高。
相關拓展
對四種晶體類型、結構質點及質點間作用力類型的小結,見下表。
晶體類型 | 結構質點 | 質點間作用力 |
原子晶體 | 原子 | 共價鍵力 |
離子晶體 | 正、負離子 | 離子鍵力 |
分子晶體 | 分子 | 分子間力氫鍵 |
金屬晶體 | 金屬原子和正離子 | 金屬鍵力 |
 石墨的層狀晶體結構
石墨的層狀晶體結構 CdI2和CdCl2的結構圖
CdI2和CdCl2的結構圖 鏈狀結構矽酸鹽的絡陰離子團示意圖
鏈狀結構矽酸鹽的絡陰離子團示意圖 架狀結構
架狀結構