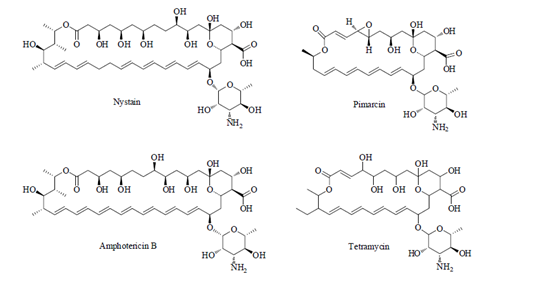
多烯類抗生素又稱多烯大環內酯類抗生素(polyene macrolide antibiotics, PEM),是由某些放線菌和真菌所產生而含有共軛雙鍵和抗真菌抗生素。都呈現多烯化合物的特徵,自從1949年從一種土壤放線菌中,分離出制黴菌素後,現已發現的有四烯、五烯、六烯和七烯等化合物。主要有兩性黴素B、金色制黴素、克念菌素B、意北黴素、菲律賓菌素、漢黴素、制黴菌素、表黴素、匹馬黴素和曲古黴素等。多烯類抗生素主要抑制真菌細胞膜的膽固醇,例如真菌與支原體的細胞膜。很多殺菌劑(一般指殺真菌劑)都屬於多烯類抗生素,如制黴菌素,它是由S.noursei產生的四烯大環內酯烯類抗生素,結構上與兩性黴素B類似,是套用比較早的一類農用抗生素。目前臨床上廣泛使用的有制黴菌素、兩性黴素B等以及匹馬黴素。
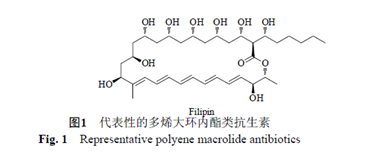
多烯大環內酯類抗生素是一類重要的抗真菌藥物,部分這類抗生素還具有抗細菌、抗病毒及免疫刺激活性。多烯大環內酯類抗生素被廣泛的用於治療局部的和全身性的真菌感染,同時還在食品行業中作為防腐劑使用。所有的多烯大環內酯類抗生素,都具有一個環內酯和一系列的共軛雙鍵。另外,依據多烯大環內酯類抗生素是否含有糖基,可以將其分為糖基化多烯大環內酯類抗生素和非糖基化多烯大環內酯類抗生素。糖基化多烯大環內酯類抗生素,還具有環外的羧基和一個特殊的糖基基團(圖1)。
1多烯大環內酯類抗生素的代表藥物
1.1制黴素
制黴菌素局部用於皮膚、膀胱、口腔及陰道等的念珠菌感染, 體內過程和抗菌作用與兩性黴素B基本相同, 但毒性更大且具有不溶解性制黴菌素脂質體首先由rAonexhPar maceuticals和Abbotlaboratories共同研製, 具有廣譜抗真菌活性, 體外試驗顯示其可有效對抗一系列真菌菌株, 如念珠菌屬、鐮刀菌屬等, 對新型隱球菌屬效果明顯, 其中某些菌株對現有抗真菌療法耐藥。
制黴素具有廣譜抗真菌作用,是膜滲透性增強劑,對念珠菌最敏感。曲菌,毛髮癬菌,穩球菌,表皮癬菌和小孢子菌對本品敏感。通常最小抑菌濃度(MIC)為1.56—6.25微克/毫升。本品對球孢子菌,組織胞漿菌也有抗菌活性。對滴蟲也有抑制作用。作用機理是與真菌細胞膜上的特異甾醇相結合,導致原生質膜破壞,通透性改變,以致重要的細胞內容物外漏而死亡,從而殺來真菌。目前用於13 歲兒童或老年人全身性真菌感染、隱球菌性腦膜炎已完成II期臨床試驗, 用於食管念珠菌病正在進行II/ III期試驗, 用於標準抗真菌療法難治性或不耐受的全身性麴黴菌或念珠菌感染病正在進行II期臨床試驗。制黴菌素脂質體減少了毒性,解決了制黴菌素的溶解性問題, 開發前景看好。
1.2兩性黴素
兩性黴素B( amphotericin B) 是結節性鏈絲菌產生的一種大環多烯類抗生素,是第一個用於深部真菌感染的藥物。兩性黴素B 能較特異地與真菌細胞膜上麥角固醇結合,產生有效的抗真菌作用,常是某些致命性全身真菌感染的唯一有效的治療藥物。但由於其對人體的毒副作用較大,特別是不可逆的腎臟毒性,嚴重限制了兩性黴素B 的臨床套用。新的藥物製劑技術可減小兩性黴素B的毒副作用。近年來,AMB含脂製劑已經廣泛套用於臨床,其不良反應明顯減少,而抗真菌作用並未降低。
1.2.1 AMB脂類製劑的作用機制及特點AMB屬於多烯類抗真菌藥物,通過與真菌細胞膜上麥角固醇結合,形成甾醇—多烯複合物,在細胞膜上形成許多微孔,使細胞膜對單價和二價陽離子的通透性增加,導致細胞膜內外的離子梯度改變,使得細胞內鉀離子和其他分子外流從而導致真菌細胞的死亡。多烯類化合物還具有引起細胞膜氧化損傷的作用,幾丁質是真菌細胞膜的重要成分,保護真菌不受外環境有害物質的破壞,多烯類化合物可以抑制細胞膜上的幾丁質合成酶,減少幾丁質的合成,破壞真菌細胞膜的穩定性,抑制真菌的生長。由於人體細胞膜含有膽固醇,結構與真菌細胞膜的麥角固醇相似,AMB可作用於人體細胞膜上的膽固醇,這是AMB引起不良反應的重要機制。AMB含脂製劑通過對AMB進行結構改造來降低AMB的不良反應尤其是AMB的腎毒性,提高了藥物作用的靶向性。L-AmB是用脂質體將AMB包裹而成的藥物;ABLC在AMB的分子上接上了脂類側鏈,形成了脂質體與AMB交織的帶樣結構;ABCD是由一些片狀結構的脂質膽固醇硫酸酯與等量的AMB混合包裹而成。AMB含脂製劑具有以下特點[1-2]:①抗真菌譜與AMB相似,不良反應相似但發生率和嚴重程度較低;②藥物易分布於網狀內皮組織、肝、脾和肺組織中,腎組織濃度減少,低血鉀少見,腎毒性均低於AMB普通製劑;③臨床可套用較高劑量,輸注速度可相對加快。AMB 3種含脂製劑的藥理學特性和不良反應並非完全相同,臨床上不宜簡單相互換用[3]。一項研究比較了AMB、L-AmB和ABLC的療效和安全性,結果顯示接受L-AmB治療的患者,出現腎毒副作用最少,患者總體病死率最低,接受ABLC的患者出現嚴重腎損害的發生率與AMB相當。目前臨床上L-AmB較為常用。
1.2.2 L-AmB 的適應症及使用注意事項AMB的腎毒性是其最常見也是最為嚴重的不良反應,嚴重限制了AMB的臨床廣泛套用。L-AmB有助於減少AMB的不良反應,儘管臨床上並未證實其療效優於普通AMB,但理論上可以使用AMB的真菌感染患者均可使用L-AmB來進行治療,L-AmB可套用於臨床上絕大多數侵襲性真菌感染。嚴重地方性真菌感染(如馬爾尼菲青黴病、組織胞漿菌病、球孢子菌病、副球孢子菌病、芽生菌病以及孢子絲菌病) 需使用AMB或L-AmB進行治療。L-AmB的適應症主要包括:①深部(系統性)真菌病患者。②病情呈進行性發展或其他抗真菌藥治療(包括AMB)無效者,如敗血症、心內膜炎、腦膜炎、腹腔、肺部、尿路等真菌感染患者。③因腎功能不全或藥物毒性而不能耐受或不適宜使用普通AMB的患者。如患者存在低鉀血症、低鎂血症、腎小管酸中毒或多尿等情況則不應選擇AMB,而應首選L-AmB。④特殊人群真菌感染:兒童、孕婦及愛滋病患者等,尤其適合存在多種藥物間相互作用的情況下。⑤作為經驗性抗真菌治療的藥物選擇,如作為粒細胞減少患者不明原因發熱時的經驗性抗真菌治療用藥。⑥高危人群侵襲性真菌感染的預防性抗真菌治療。⑦L-AmB還可用於利什曼原蟲病的治療。然而,L-AmB價格高,限制了其在臨床的推廣和套用,其臨床使用價值和成本—效益值得進一步研究。與AMB類似,使用L-AmB也應注意以下事項:注意應低溫冷藏(2~10℃)條件下貯存;使用過程中應注意避光;使用注射用水溶解後加入5%的葡萄糖注射液中緩慢輸入(輸液濃度<0.15mg/mL(75mg/500mL);輸液速度:<30滴/分,每劑滴注時間至少6h);除了激素外,不應與其他藥物混合滴注。
1.2.3 L-AmB在臨床的合理套用
L-AmB 在侵襲性真菌感染中的套用念珠菌病、隱球菌病和麴黴是臨床最為常見的
真菌感染。體外藥敏檢測發現L-AmB對臨床分離的酵母型真菌具有很好的敏感性,可作預防和治療此類真菌感染的藥物選擇。曲菌多對L-AmB敏感,麴黴可選用L-AmB。隨著新型三唑類和棘白菌素類抗真菌藥物的出現,目前有關念珠菌病和麴黴的診療指南常推薦首選此類藥物,而AMB和L-AmB常用於重症病例或作為上述抗真菌藥物治療無效或不能耐受時的補救治療措施。對於隱球菌腦膜炎而言,IDSA的診療指南推薦首選AMB或L-AmB進行治療,在誘導期強調聯合使用AMB或L-AmB和氟胞嘧啶的重要性。對於重症隱球菌肺炎則按照隱球菌腦膜炎來治療。L-AmB也是治療毛霉病、馬爾尼菲青黴病及組織胞漿菌病毛霉病的主要藥物。毛霉病的治療原則是:治療基礎疾病,早期給予大劑量AMB輔以外科手術治療。近年來推薦AMB含脂質製劑作為毛霉病的初始治療藥物。目前推薦治療馬爾尼菲青黴病的方案[17]:先靜脈滴注L-AmB 2周,而後再口服伊曲康唑10周;病情較輕的患者可口服伊曲康唑8周;也可使用伏立康唑治療本病。對於組織胞漿菌病而言,臨床研究顯示L-AmB的療效優於AMB。對於嚴重的組織胞漿菌病應靜脈使用L-AmB 2周以上或直至病情緩解,對此治療反應良好者,再口服伊曲康唑進行維持治療。對於伴有腦膜炎的患者,應將L-AmB的使用時間延長到4~6周。對於其他的新發真菌感染如鐮孢霉屬感染、球孢子菌病、副球孢子菌病及芽生菌病等也可使用AMB或L-AmB進行治療。
1.3匹馬黴素
匹馬黴素( natamycin) 是一種廣譜、高效、毒性低的四烯類抗真菌藥物,其作用機制是與真菌細胞膜上的麥角固醇結合,改變細胞膜的通透性,導致細胞內鉀離子、胺基酸、核苷酸等重要物質外漏。破壞細胞正常代謝,抑制其生長。對各種絲狀菌及念珠菌效果好,對鐮刀菌有效率為(81~85)%,暗色孢科真菌有效率90%,酵母菌有效率75%。由於其混懸液的角膜通透性差,因此對角膜深部感染,尤其合併前房積膿者效果不佳,且長時間使用可產生耐藥性故多與其它抗真菌藥物聯合使用。
2. 多烯大環內酯類抗生素的作用機理研究
多烯大環內酯類抗生素中的多烯結構有助於結合甾醇,尤其和真菌細胞膜中的重要組成部分麥角甾醇具有高親和性。傳統觀點認為,多烯大環內酯類抗生素通過與真菌細胞膜中的甾醇相結合,形成一種複合物。這種複合物將進一步形成貫穿整個細胞膜的通道。從而導致胞內的小分子物質和離子的大量流失,進而導致細胞死亡。此外,多烯大環內酯類抗生素也與動物細胞膜中的膽固醇具有一定的親和性。儘管這種親和性與麥角甾醇相比較低,但這種親和性仍然會導致多烯大環內酯類抗生素產生毒副作用細胞膜中的甾醇通過兩種途徑,來影響細胞膜的功能:一種是通過對脂質雙分子層的結構或者對其熱力學性質產生影響;另一種則是通過直接與酶或者其他細胞膜成分相結合而使其激活或者滅活。以兩性黴素B為例,其通道的形成,既可以歸因於兩性黴素B與甾醇的相互結合,又可以解釋為甾醇為跨膜通道的形成提供了一種適宜的環境。對於前者而言,兩性黴素B的選擇性是由其與真菌中的麥角甾醇具有更強的親和力決定的。在這種情況下,其與麥角甾醇形成更穩定的複合物,隨後進一步自組裝形成跨膜通道,這也是“主要複合物” (primarycomplexes)假說。而對於後者而言,兩性黴素B的選擇性是由於麥角甾醇引起的更強的構型有序性(conformational ordering)而引起的。近年來,進一步的研究回答了跨膜通道是如何形成的。Cohen的研究表明兩性黴素B單體首先在細胞膜與細胞外液的臨界界面上聚集,隨後兩性黴素B分子插入膜中,形成一個V字形的孔隙。這時,V型孔隙僅僅插入而並未貫穿細胞膜,而且其形成無需甾醇的參與。在存在V型孔隙的基礎上,當兩性黴素B的濃度超過一個臨界值,且同時細胞膜中有甾醇類物質存在時,這個V型親水孔隙會逐漸變成貫穿於整個細胞膜的跨膜孔道。te Welscher等研究發現,納他黴素(也稱匹馬黴素)僅僅需要與真菌中的麥角甾醇相結合而無需形成跨膜通道,就可以阻止真菌生長。在隨後的幾年裡,大量實驗證明了多烯大環內酯類抗生素的確只需與真菌細胞膜中的麥角甾醇結合,就可以實現殺真菌的功能。因此,傳統的觀點現在被證實是錯誤的,跨膜通道抑制真菌的機制,只是作為一種次要補充機制發揮作用。
3.總結與展望
多烯大環內酯類抗生素是一種抗真菌效果優秀、且在多年臨床套用後仍然具有優良療效的抗生素,人們對它的多方面研究從未間斷。其中包括:從早期的單基因缺失驗證各個基因功能,到目前可以有目的性的通過生物工程手段對該類抗生素的合成過程加以控制,確定該抗生素的新的準確的作用機理等等,這些相關研究已為人們提供了豐富的基礎研究資料。隨著合成生物學的發展和人們對多烯大環內酯類抗生素深入了解,正確認識多烯大環內酯類抗生素生物合成過程中各個元件指日可待。