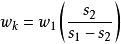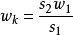簡介,發展階段,測定放射性比度的同位素稀釋法,直接稀釋法,反稀釋法,雙重稀釋法,亞計量同位素稀釋法,亞計量沉澱法,亞計量萃取法,亞計量離子交換法,亞一超當量通用同位素稀釋法,套用,
簡介
自從海維西(Hevesy)等於1932年提出同位素稀釋法以來,已經按照這種“稀釋”原理創建了多種分析方法,並廣泛地套用於有機物和無機物的測定。同位素稀釋法包括穩定同位素稀釋和放射性同位素稀釋。前者使用質譜計測量質量變化,後者使用計數器測量放射性比度(單位重量物質中的放射性強度)的變化。前者所用測量儀器貴重,花費的測量時間較長,而能測出的稀釋程度較小(靈敏度較低);後者簡便易行,靈敏度可達到與活化分析相同,因而後者得到了較廣泛泛的套用和較大的發展。
發展階段
同位素稀釋法的優點是避免了複雜混合物體系定量分離、純化的困難。同位素稀釋法發展到現在,基本上可分為三個階段:
1.測定放射性比度的同位素稀釋;
2.亞計量同位素稀釋;
3.亞一超當量通用同位素稀釋。
這三個發展階段不是截然分開的,而是至今仍在交錯繼續發展。
所用的分離方法,除沉澱法外還有溶劑萃取、離子交換、色譜分離、蒸餾等方法。同位素稀釋法的準確度主要取決於:所加指示劑的純度和比活度、分出待測物的純度和比活度、指示劑稀釋的程度等。
測定放射性比度的同位素稀釋法
這種方法的最基本的原則是將穩定同位素(測定物或載體)和放射性同位素(指示劑或測定物)充分混合、交換,達到同位素稀釋後,分離出部分所測元素(多數情況是其化合物),測定其化學分離產率和放射性(求出放射性比度)。這種方法的計算公式有多種,其中主要有三種:
直接稀釋法
設A1為指示劑引入的總放射性;A2為分離出來的放射性(A2<A1);即:w1為指示劑引人的所測元素的重量;wk為試樣中原來含有的所測元素(非放射性)de重量;。w2為所測元素被分離出的重量(w2<wk),s1為指示劑的原來的放射性比度;s2為稀釋後的放射性比度,s2也是分出部分(w2)的放射性比度。
按以下公式可計算出wk:
反稀釋法
所測定的物質是放射性的,加人非放射性載體進行稀釋。在核化學研究、裂變產物分析和活化分析中常常套用。設A0為所要求測定的放射性;w1為加入的載體量;w2為分離出的載體量(w2<w1);A2為分出部分(w2)的放射性,則
在生物化學研究中常常使用微量標記化合物,需要測定其含量(例如研究代謝作用後的分布),這種情況下的所測標記物的放射性比度是已知的。
設所測物的含量為wk,其放射性比度為s1=A0/wk。w1為所加入的載體量;s2=A0/(wk +w1)為稀釋後的放射性比度(可以由分出部分測知),
雙重稀釋法
這種方法常用於生物化學研究中,所測物是放射性的,而且其放射性比度是未知的。
設s1為所測物原有的放射性比度;s2為第一次稀釋後的放射性比度,w1(毫克)為第一次載體加入量,
亞計量同位素稀釋法
由於以上各方法都需要測定放射性比度,其中分出部分的定要套用一般化學分析法。如果能設法避免測定放射性比度這一手續,則一方面可使分析方法簡便,另一方面可使同位素稀釋法的靈敏度不受善通化學分析法的限制。1957一1958年,弗來米林(Fremilin),阿里阿加(Arriaga)和齊馬柯夫分別提出了這種不測定放射性比度的同位素稀釋法。特別是後者首先提出的套用等量萃取分離的方法,開闢了一個新途徑,大大提高了同位素稀釋法的分析靈敏冷。自1960年以來,魯澤卡(Ruzieka)等人進行了系統深人的研究,使這種分析方法得到了相當大的發展,由於這種方法的關鍵是使用亞計量試劑進行等量分離,所以被命名為亞計量法(subosti-chiolery),現在這個名稱已經在國際上被廣泛採用。
根據所用分離手段,可以分為以下幾種方法:
亞計量沉澱法
取甲和乙兩份等量放射性同位素溶液,各含待測元素。克,其放射性為Ao,放射性比度為w。將乙溶液加到含x克待測元素的試液中,進行同位素稀釋後,其放射性比度為s1。如果從甲和乙(已與試液混合)溶液中分另l]等量沉澱出待測元素w0克,分別測得其放射性為Aa和Ab。
這樣的方法就避免了用一般化學法定量,不必求出s1和s2而直接可用放射性Aa和Ab進行計算。但在實臉技術上,定量轉移沉澱是比較困難的。
亞計量萃取法
本法基本上有三種方案:
(1)齊馬柯夫法
(2)格拉申柯法
(3)雙重亞計量同位素稀釋法
亞計量離子交換法
本法的原理與以上方法類似,只是分離手段不同;一般是在兩份試液中加入示蹤劑進行同位素稀釋以後,再加入等量的亞計量絡合劑(例如EDTA兒生成中性或帶負電荷的絡合物;通過陽離子交換樹脂柱,將所測元素等量分離出來;其計算公式與亞計量萃取法相同。
從含有不同量的待測離子的溶液中等量分出很少量的該種離子,必須滿足以下三條件:
(1)絡合劑的加入量必須小於相應該離子的化學計算量;
(2)絡合劑必須與該離子定量反應;
(3)所生成的絡合物必須能夠很容易地與過剩的待測離子互相分離(這三個條件對亞計量萃取法一也類似適)。
亞一超當量通用同位素稀釋法
1974年柯拉斯(Klas)等人發展了一種稱作亞一超當量同位素稀釋的新方法;其分析技術是取用兩系列試液進行同位素稀釋,各加入同量試劑,此試劑的用量對應每份試液中所測元素量,有的是亞當量,有的是超當量,因此稱為亞一超當量同位素稀釋。通過實臉和數學推算的研究,發現以上所述亞計量同位素稀釋只是其中的一種特殊情況。本法原理既可用於直接同位素稀釋,又可用於反同位素釋;既可用來測定非放射性物質,也可用來測定放射性物質,而具有通用的特徵;於是對這種方法又稱作通用同位素稀釋法。
此法所受的限制主要是化學反應平衡常數和試劑用量。試劑用量太少時,由於實際上不產生反應產物,而不能確定同位素稀釋曲線。
套用
同位素稀釋法已廣泛用於生物化學方面,如維生素、抗生素等複雜物質的分析;有機化學方面,如胺基酸、脂肪酸、殺蟲劑、聚合物等複雜混合物的分析;無機化學方面,特別是對性質類似不易分離的稀土元素的定量測定。