化學弛豫原理是一整套動力學的研究 方法。
以反應A+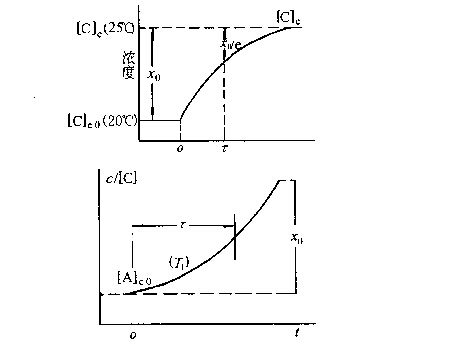

B拼籠C+D為例:當體系溫度由}1一}~1+△一’一了’2時, }6 體系各組分的平衡濃度應分別為L}}}"L}}}}LC}e,La}t},由於 擾動時間極短(約為幾個微秒),體系各組分濃度的變化出現滯 後,來不及達到平衡濃度,而分別為「.A] _ [A]a‘或[C」= 「C:。十:,.,為微變數二隨反應過程的進行而趨近於平衡濃度 L}_E,,L}"J},二。設為二級反應,則一d[A j}'dt=}iL}Jt1}〕一} t} }}ltnJ,}1=}t轉化為d.} }dt=一二}}f}L}}},[ F3一}。)+壽b(ICI、 十【}〕}}}二一二一t。令t‘o時之二為l’「。〔最大偏離),參見示 意圖。積分上式,J·=x }exp〔一:/:)。當,二二r}f},則t一二,二 即為弛像時問(re}}x}tlicrm time。由於二一‘=}r}e八}e + L}}E.) + }v}仁}}e+LaJt.),僅是由平衡濃度及速率常數所決定,是}z條 件下的反應性質的特性常數,具有時間量綱。聯立此式及K, k,l}b,可求得k,及k。。這種由原來的二級〔或更高級)的反應 動力學轉變為一級動力學規律〔dx }d,二一二》的方法是化學 動力學中的線性化方法。對於其他複雜的動力學規律也可用 弛豫法求正、逆反應速率常數,並已形成一整套動力學的研究 方法。
