力平之®(非諾貝特膠囊),供成人使用用於治療成人飲食控制療法效果不理想的高膽固醇血症(IIa型),內源性高甘油三酯血症,單純型(IV型)和混合型(IIb和III型)。特別是適用於以高密度脂蛋白降低和低密度脂蛋白中度升高為特徵的血脂異常患者,及2型糖尿病合併高脂血症的患者。在服藥過程中應繼續控制飲食。目前,尚無長期臨床對照研究證明非諾貝特在動脈粥樣硬化併發症一級和二級預防方面的有效性。
基本介紹
- 藥品名稱:非諾貝特膠囊
- 漢語拼音:Fei Nuo Bei Te Jiao Nang
- 藥品類型:工傷醫保乙類雙跨
- 用途分類:調血脂藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,批准文號,生產企業,核准日期,修訂日期,
成份
化學名稱為:2 - [ 4 - ( 4 -氯苯甲醯基 ) 苯氧基 ] – 2 - 甲基 - 丙酸甲基乙酯
化學結構式:
分子式:C20H21ClO4
分子量:360.84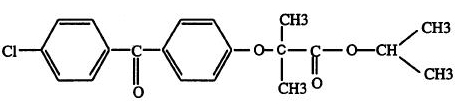
化學結構式:
分子式:C20H21ClO4
分子量:360.84

性狀
本品為硬膠囊,內容物為白色粉末。
適應症
供成人使用
用於治療成人飲食控制療法效果不理想的高膽固醇血症(IIa型),內源性高甘油三酯血症,單純型(IV型)和混合型(IIb和III型)。特別是適用於以高密度脂蛋白降低和低密度脂蛋白中度升高為特徵的血脂異常患者,及2型糖尿病合併高脂血症的患者。
在服藥過程中應繼續控制飲食。
目前,尚無長期臨床對照研究證明非諾貝特在動脈粥樣硬化併發症一級和二級預防方面的有效性。
用於治療成人飲食控制療法效果不理想的高膽固醇血症(IIa型),內源性高甘油三酯血症,單純型(IV型)和混合型(IIb和III型)。特別是適用於以高密度脂蛋白降低和低密度脂蛋白中度升高為特徵的血脂異常患者,及2型糖尿病合併高脂血症的患者。
在服藥過程中應繼續控制飲食。
目前,尚無長期臨床對照研究證明非諾貝特在動脈粥樣硬化併發症一級和二級預防方面的有效性。
規格
200mg。
用法用量
配合飲食控制,該藥可長期服用,並應定期監測療效。
- 200mg規格的力平之微粒化膠囊每日僅需服用一粒,與餐同服。
- 當膽固醇的水平正常時,建議減少劑量。
- 200mg規格的力平之微粒化膠囊每日僅需服用一粒,與餐同服。
- 當膽固醇的水平正常時,建議減少劑量。
不良反應
- 與其他貝特類藥物合用時,有報導出現過肌肉功能失調(彌散性疼痛,觸痛感,肌無力)和少見的嚴重的橫紋肌溶解症。這些不良反應在停藥後大多可逆轉 (詳見警告部分)。
- 其他較少發生、中等程度的不良反應也有報導:
- 胃或腸道消化功能失調,如消化不良;
- 轉氨酶升高(詳見注意事項部分);
- 有報導偶見過敏性皮膚反應,如皮疹,瘙癢,蕁麻疹,或光敏反應。在一些病例中即使停藥幾個月,當皮膚暴露於陽光或人工紫外線後,仍會出現紅斑,丘疹,花斑疹和濕疹。
目前尚無長期對比研究對不良反應進行全面評估,尤其是患膽結石的危險性。
- 其他較少發生、中等程度的不良反應也有報導:
- 胃或腸道消化功能失調,如消化不良;
- 轉氨酶升高(詳見注意事項部分);
- 有報導偶見過敏性皮膚反應,如皮疹,瘙癢,蕁麻疹,或光敏反應。在一些病例中即使停藥幾個月,當皮膚暴露於陽光或人工紫外線後,仍會出現紅斑,丘疹,花斑疹和濕疹。
目前尚無長期對比研究對不良反應進行全面評估,尤其是患膽結石的危險性。
禁忌
在下列情況中,此藥物禁止使用:
- 對非諾貝特過敏者禁用;
- 肝功能不全者;
- 腎功能不全者(詳見警告部分);
- 已知在治療過程中使用非諾貝特或與之結構相似的藥物,尤其是酮洛芬時,會出現光毒性或光敏反應;
- 與其他貝特類藥物合用(詳見藥物相互作用部分);
- 兒童禁用。
該藥通常不建議與HMG-CoA還原酶抑制劑聯合使用(詳見藥物相互作用部分),在哺乳期也不應使用(詳見孕期與哺乳期部分)。
- 對非諾貝特過敏者禁用;
- 肝功能不全者;
- 腎功能不全者(詳見警告部分);
- 已知在治療過程中使用非諾貝特或與之結構相似的藥物,尤其是酮洛芬時,會出現光毒性或光敏反應;
- 與其他貝特類藥物合用(詳見藥物相互作用部分);
- 兒童禁用。
該藥通常不建議與HMG-CoA還原酶抑制劑聯合使用(詳見藥物相互作用部分),在哺乳期也不應使用(詳見孕期與哺乳期部分)。
注意事項
警告
已有報導貝特類藥物可以引起與肌肉有關的不良反應,包括較少發生的橫紋肌溶解。這種情況常發生在低血漿白蛋白時。
在任何病人中出現與肌肉有關的症狀都應考慮,包括彌散性肌肉痛,肌肉觸痛,以及肌源性CPK大量增加(超過正常濃度5倍以上),在此種情況下,應立即停止用藥。
另外,發生肌肉不良反應的危險性在與HMG-CoA還原酶抑制劑或其他貝特類藥物合用後會增加(詳見藥物相互作用部分)。
由於處方中乳糖的存在,此藥物禁用於患有先天性半乳糖症,葡萄糖或半乳糖吸收障礙綜合徵,或乳糖酶缺乏症患者。
使用注意事項
- 如果在服用幾個月(3~6個月)後,血脂未得到有效的改善,應考慮補充治療或採用其他方法治療
- 一些病人可出現轉氨酶升高,通常為一過性的。就目前所知,這些似乎表明:
在治療的最初12個月,每隔3個月全面檢查轉氨酶濃度;
當ASAT和ALAT升高至正常值的3倍以上時,應停止治療。
- 在與口服抗凝劑合用時,應密切監測凝血酶原的濃度,以INR表示(詳見藥物相互作用部分)。
已有報導貝特類藥物可以引起與肌肉有關的不良反應,包括較少發生的橫紋肌溶解。這種情況常發生在低血漿白蛋白時。
在任何病人中出現與肌肉有關的症狀都應考慮,包括彌散性肌肉痛,肌肉觸痛,以及肌源性CPK大量增加(超過正常濃度5倍以上),在此種情況下,應立即停止用藥。
另外,發生肌肉不良反應的危險性在與HMG-CoA還原酶抑制劑或其他貝特類藥物合用後會增加(詳見藥物相互作用部分)。
由於處方中乳糖的存在,此藥物禁用於患有先天性半乳糖症,葡萄糖或半乳糖吸收障礙綜合徵,或乳糖酶缺乏症患者。
使用注意事項
- 如果在服用幾個月(3~6個月)後,血脂未得到有效的改善,應考慮補充治療或採用其他方法治療
- 一些病人可出現轉氨酶升高,通常為一過性的。就目前所知,這些似乎表明:
在治療的最初12個月,每隔3個月全面檢查轉氨酶濃度;
當ASAT和ALAT升高至正常值的3倍以上時,應停止治療。
- 在與口服抗凝劑合用時,應密切監測凝血酶原的濃度,以INR表示(詳見藥物相互作用部分)。
孕婦及哺乳期婦女用藥
孕期
- 動物試驗結果顯示未見有致畸作用。
- 到目前為至,臨床尚未出現致畸和胚胎毒性。但對孕期使用非諾貝特的跟蹤不足以排除任何危險,故一般孕婦應禁用。
- 貝特類藥物不用於孕婦,但通過飲食控制不能有效降低高甘油三酯(>10g/L)而增加母體患急性胰腺炎危險的情況時除外。
哺乳期
目前尚無非諾貝特可進入母乳的資料。但在哺乳期禁用。
- 動物試驗結果顯示未見有致畸作用。
- 到目前為至,臨床尚未出現致畸和胚胎毒性。但對孕期使用非諾貝特的跟蹤不足以排除任何危險,故一般孕婦應禁用。
- 貝特類藥物不用於孕婦,但通過飲食控制不能有效降低高甘油三酯(>10g/L)而增加母體患急性胰腺炎危險的情況時除外。
哺乳期
目前尚無非諾貝特可進入母乳的資料。但在哺乳期禁用。
兒童用藥
兒童禁用。
老年用藥
推薦使用普通成人劑量,如有腎功能損害可以減少劑量。
藥物相互作用
禁止與以下藥物合併使用
+ 其他貝特類藥物:增加不良反應如橫紋肌溶解症和兩種分子間的藥效拮抗作用的發生率。
不建議合併使用的藥物
+HMG-CoA還原酶抑制劑:增加肌肉不良反應如橫紋肌溶解症的發生率。
謹慎合用的藥物
+口服抗凝劑:與口服抗凝劑合用後,增加出血的危險性(由於它們與血漿蛋白發生了置換反應)。
對INR進行更頻繁的檢查和監控。在用非諾貝特治療期間和停藥8天后,調節口服抗凝劑的劑量。
+ 其他貝特類藥物:增加不良反應如橫紋肌溶解症和兩種分子間的藥效拮抗作用的發生率。
不建議合併使用的藥物
+HMG-CoA還原酶抑制劑:增加肌肉不良反應如橫紋肌溶解症的發生率。
謹慎合用的藥物
+口服抗凝劑:與口服抗凝劑合用後,增加出血的危險性(由於它們與血漿蛋白發生了置換反應)。
對INR進行更頻繁的檢查和監控。在用非諾貝特治療期間和停藥8天后,調節口服抗凝劑的劑量。
藥物過量
對症治療。
藥理毒理
藥理作用
微粒化非諾貝特是力平之的一種新型製劑,含有200mg高生物利用度非諾貝特。
非諾貝特可降低血清膽固醇20-25%,降低甘油三酯40-50%。
- 膽固醇的降低是通過降低低密度動脈粥樣化成分(VLDL和LDL),並且通過降低總膽固醇/HDL膽固醇比率取得的(該比率在動脈粥樣化高脂血症中升高),從而改善了血漿中膽固醇的分布。
- 高膽固醇和動脈粥樣硬化的關係,以及動脈硬化與冠狀動脈疾病危險的關係已得到證實。低水平的HDL可增加冠狀動脈疾病危險。甘油三酯升高可增加心血管疾病危險,但還不能確定這種關係是獨立存在的。
另外,甘油三酯可能不僅與動脈粥樣化有關,而且與血栓形成有關。
- 通過有效延長治療期(顯著降低膽固醇),血管外膽固醇的沉積(腱和結節黃瘤)能夠有明顯的消退,甚至完全消除。
- 在高脂血症病人中非諾貝特有利尿酸的作用,可使血漿中尿酸平均降低25%。
- 非諾貝特治療增加apoA1、降低apoB,從而改善apoA1/apoB比率,該比值被認為是動脈粥樣化的標誌。
- 動物研究和人體臨床研究表明,非諾貝特具有抗血小板凝集的作用,該作用是通過降低ADP、花生四烯酸和腎上腺素所致的凝集反應而實現的。
- 非諾貝特通過激活PPARα(過氧化物酶增殖體激活受體α),激活脂解酶和減少載脂蛋白CIII合成,使血漿中脂肪降解和甘油三酯清除明顯增加。
毒理研究
在使用劑量超過45mg/kg時發現了小鼠和大鼠肝臟的腫瘤和/或肝細胞癌,在此劑量下同樣發現大鼠胰腺腺泡細胞瘤和腺癌,在長期套用60mg/kg的大鼠睪丸發現了間質細胞瘤。致癌研究結果顯示,套用非諾貝特治療的齧齒動物的腫瘤發生率分別在3個器官明顯增加:肝臟(腫瘤和肝細胞癌)、胰腺(腺泡細胞瘤和腺癌)和睪丸(間質細胞瘤)。
大鼠和小鼠的毒性研究結果顯示:過度的過氧化氫酶刺激會引起毒性反應出現。這種變化僅在小齧齒動物出現,其它動物標本中尚未發現。且與人類的治療無相關性。
下列實驗結果證實非諾貝特無潛在的致突變作用:艾姆斯試驗(Ames test)、小鼠淋巴組織瘤實 驗、染色體畸變實驗以及不定期的DNA合成實驗等。
生殖研究表明,非諾貝特無致畸作用,但當使用孕婦毒性劑量時,在大鼠和兔子可以引起某些胚胎毒性。當大鼠使用劑量為75mg/kg/天以上時,會出現延遲分娩和減少出生後存活率。
微粒化非諾貝特是力平之的一種新型製劑,含有200mg高生物利用度非諾貝特。
非諾貝特可降低血清膽固醇20-25%,降低甘油三酯40-50%。
- 膽固醇的降低是通過降低低密度動脈粥樣化成分(VLDL和LDL),並且通過降低總膽固醇/HDL膽固醇比率取得的(該比率在動脈粥樣化高脂血症中升高),從而改善了血漿中膽固醇的分布。
- 高膽固醇和動脈粥樣硬化的關係,以及動脈硬化與冠狀動脈疾病危險的關係已得到證實。低水平的HDL可增加冠狀動脈疾病危險。甘油三酯升高可增加心血管疾病危險,但還不能確定這種關係是獨立存在的。
另外,甘油三酯可能不僅與動脈粥樣化有關,而且與血栓形成有關。
- 通過有效延長治療期(顯著降低膽固醇),血管外膽固醇的沉積(腱和結節黃瘤)能夠有明顯的消退,甚至完全消除。
- 在高脂血症病人中非諾貝特有利尿酸的作用,可使血漿中尿酸平均降低25%。
- 非諾貝特治療增加apoA1、降低apoB,從而改善apoA1/apoB比率,該比值被認為是動脈粥樣化的標誌。
- 動物研究和人體臨床研究表明,非諾貝特具有抗血小板凝集的作用,該作用是通過降低ADP、花生四烯酸和腎上腺素所致的凝集反應而實現的。
- 非諾貝特通過激活PPARα(過氧化物酶增殖體激活受體α),激活脂解酶和減少載脂蛋白CIII合成,使血漿中脂肪降解和甘油三酯清除明顯增加。
毒理研究
在使用劑量超過45mg/kg時發現了小鼠和大鼠肝臟的腫瘤和/或肝細胞癌,在此劑量下同樣發現大鼠胰腺腺泡細胞瘤和腺癌,在長期套用60mg/kg的大鼠睪丸發現了間質細胞瘤。致癌研究結果顯示,套用非諾貝特治療的齧齒動物的腫瘤發生率分別在3個器官明顯增加:肝臟(腫瘤和肝細胞癌)、胰腺(腺泡細胞瘤和腺癌)和睪丸(間質細胞瘤)。
大鼠和小鼠的毒性研究結果顯示:過度的過氧化氫酶刺激會引起毒性反應出現。這種變化僅在小齧齒動物出現,其它動物標本中尚未發現。且與人類的治療無相關性。
下列實驗結果證實非諾貝特無潛在的致突變作用:艾姆斯試驗(Ames test)、小鼠淋巴組織瘤實 驗、染色體畸變實驗以及不定期的DNA合成實驗等。
生殖研究表明,非諾貝特無致畸作用,但當使用孕婦毒性劑量時,在大鼠和兔子可以引起某些胚胎毒性。當大鼠使用劑量為75mg/kg/天以上時,會出現延遲分娩和減少出生後存活率。
藥代動力學
非諾貝特在血漿中未發現原型存在,主要代謝產物為非諾貝特酸。
通常服藥後5小時可達最大血漿濃度。每天服用力平之200mg微粒化膠囊一粒後的平均血藥濃度為15ug/ml。
同一病人連續治療,其血藥濃度水平是穩定的。
非諾貝特酸與血漿白蛋白結合緊密,可從蛋白結合部位取代維生素K拮抗劑,加強抗凝效果(詳見藥物相互作用部分)。
非諾貝特酸在血液中消除半衰期約為20小時。
該藥主要從尿中排泄,幾乎所有產物在6天內從體內排除。
非諾貝特主要以非諾貝特酸的形式消除,還有其葡糖醛酸衍生物。
單劑量和多劑量給藥藥代動力學研究表明,非諾貝特無蓄積效應。
血液透析不能清除非諾貝特酸。
通常服藥後5小時可達最大血漿濃度。每天服用力平之200mg微粒化膠囊一粒後的平均血藥濃度為15ug/ml。
同一病人連續治療,其血藥濃度水平是穩定的。
非諾貝特酸與血漿白蛋白結合緊密,可從蛋白結合部位取代維生素K拮抗劑,加強抗凝效果(詳見藥物相互作用部分)。
非諾貝特酸在血液中消除半衰期約為20小時。
該藥主要從尿中排泄,幾乎所有產物在6天內從體內排除。
非諾貝特主要以非諾貝特酸的形式消除,還有其葡糖醛酸衍生物。
單劑量和多劑量給藥藥代動力學研究表明,非諾貝特無蓄積效應。
血液透析不能清除非諾貝特酸。
貯藏
乾燥處保存。
包裝
10粒/盒,鋁塑泡罩包裝。
有效期
36個月。
執行標準
JX20090069
批准文號
H20100602
生產企業
法國利博福尼製藥公司
核准日期
2009年7月20日
修訂日期
2011年4月25日
