基本介紹
- 中文名:共軛二烯烴
- 英文名:conjugated diolefine
- 別稱:共軛雙烯
- 化學式:CnH2n-2(n≥4)
- 套用:合成橡膠、溶劑
- 化學反應:加成反應,雙烯合成及聚合反應等
簡介,化學性質,化學反應,親電加成反應,電環化反應,聚合反應,雙烯合成,合成方法進展,套用,
簡介
又名共軛雙烯。是二烯烴的一類,分子中含有兩個相隔一個單鍵的雙鍵(一般為碳碳雙鍵)。其通式為CnH2n-2(n≥4),如1,3-丁二烯(CH2=CH-CH=CH2)。能以1,4-和1,2-兩種形式發生加成反應,還可發生雙烯合成反應(即Diels-Alder反應)及聚合反應等。可用合成的方法而製得。用於合成橡膠、溶劑,是重要的有機化工原料。

化學性質
共軛二烯烴的物理性質和烷烴、烯烴相似。碳原子數較少的二烯烴為氣體,例如1,3-丁二烯為沸點-4℃的氣體;碳原子數較多的二烯烴為液體,如異戊二烯為沸點34℃的液體。它們都不溶於水而溶於有機溶劑。
共軛二烯烴具有烯烴雙鍵的一些化學性質,但由於是共軛體系,在加成和聚合反應中,又具備一些特有的規律。共軛二烯烴含有共扼雙鍵,化學性質活潑,易發生均聚和共聚反應,也能與許多物質發生加成反應。
化學反應
親電加成反應
和1,2-加成和1,4-加成:極性試劑有利於1,4-加成;低溫有利於1,2-加成,高溫有利於1,4-加成。

共軛二烯烴同普通烯烴一樣,容易與鹵素、鹵化氫等親電試劑發生加成反應;它的特點是比普通烯烴更容易發生加成反應,但由於中間體變化,生成多種加成產物.共軛二烯的部分加成產物,即1,2-和1,4-加成產物,經歷不同的中間體,如1,3-丁二烯與HBr反應,生成相應的碳正離子Ia1或Ia2(Scheme1).共軛二烯的結構是影響部分加成中間體的因素之一.因而,1,2-和1,4-加成產物的比例不僅受共軛二烯結構的影響,也隨反應條件,如溫度、溶劑和催化劑體系等的改變而改變;多數情況下,得到兩種反應產物。
電環化反應
電環化反應是周環反應的一種類型 ,所謂周環反應是指在化學反應過程中能形成環狀過渡態的一些協同反應, 它不受溶劑極性的影響, 也不受催化劑和引發劑的影響 ,反應條件為加熱或光照 。在整個反應過程中 ,不產生任何活性中間體。反應中有兩個或更多的鍵, 同時破裂和生成。即以協同的方式進行 。Woodward Hoffmann 於 1965 年提出了電環化反應選擇規則, 一般教科書都以π電子數和反應條件的關係來表示該規則。對於含偶數碳原子的共軛多烯 ,一般都以中性分子的形式形成共軛體系 ,這類多烯含有的 π電子數正好等於所含碳原子數 。如 :丁二烯, 所含碳原子數和 π電子數都是 4 個, 即可歸為 4n 個 π電子體系(n =1 , 2 , 3 ……)。而己三烯所含碳原子數和π電子數都是 6 個 , 可歸為 4n +2 個 π電子體系 。(n =0 , 1 , 2 , 3 ……)所以這類多烯的電環化反應學生易於掌握。但對於含奇數個碳原子的多烯 ,一般以帶電離子的形式形成共軛體系, 這種離子的 π電子數和所含碳原子數不再相等 ,學生對這類多烯的電環化反應感到難以理解 。因此在教學中擬採用以下方法對含奇數個碳原子的共軛多烯體系的電
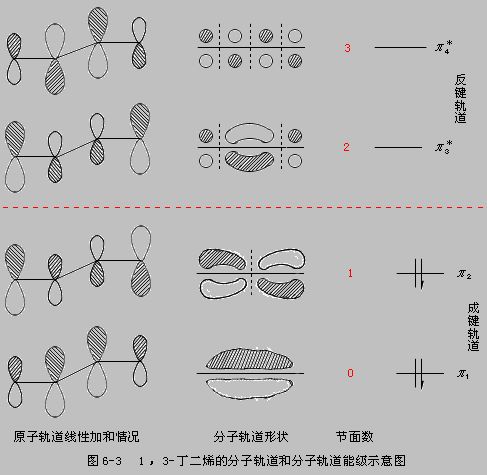
環化反應選擇規則進行分析講解。首先把這類多烯分成 4n +1 和 4n -1(n =1, 2 , 3……)個碳原子兩種類型,然後具體地分析這兩種類型的正負離子。4n +1 個碳原子的正離子,如:戊二烯基正離子含 5 個碳原子(n =1),4 個π電子,可歸為 4n 個π電子體系;4n -1個碳原子的負離子,如:烯丙基負離子,含有 3 個碳原子(n =1), 4 個π電子,亦可歸為 4n 個 π電子體系,即4n +1 個碳原子的正離子和 4n -1 個碳原子的負離子都可屬於 4n 個π電子體系。而 4n +1 個碳原子的負離子,如:戊二烯基負離子含 5 個碳原子(n =1), 6 個 π電子,可歸為 4n +2 個 π電子體系;4n -1 個碳原子的正離子,如:烯丙基正離子含 3 個碳原子(n =1), 2 個 π電子,可歸為 4n +2 個 π電子體系,即 4n +1 個碳原子的負離子和 4n -1 個碳原子的正離子都屬於 4n+2 個π電子體系。這樣含奇數個碳原子的共軛多烯體系電環化反應選擇規則可歸納如右圖。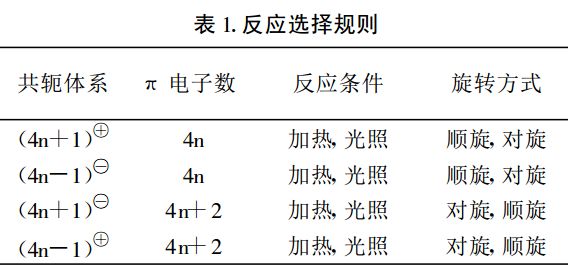
環化反應選擇規則進行分析講解。首先把這類多烯分成 4n +1 和 4n -1(n =1, 2 , 3……)個碳原子兩種類型,然後具體地分析這兩種類型的正負離子。4n +1 個碳原子的正離子,如:戊二烯基正離子含 5 個碳原子(n =1),4 個π電子,可歸為 4n 個π電子體系;4n -1個碳原子的負離子,如:烯丙基負離子,含有 3 個碳原子(n =1), 4 個π電子,亦可歸為 4n 個 π電子體系,即4n +1 個碳原子的正離子和 4n -1 個碳原子的負離子都可屬於 4n 個π電子體系。而 4n +1 個碳原子的負離子,如:戊二烯基負離子含 5 個碳原子(n =1), 6 個 π電子,可歸為 4n +2 個 π電子體系;4n -1 個碳原子的正離子,如:烯丙基正離子含 3 個碳原子(n =1), 2 個 π電子,可歸為 4n +2 個 π電子體系,即 4n +1 個碳原子的負離子和 4n -1 個碳原子的正離子都屬於 4n+2 個π電子體系。這樣含奇數個碳原子的共軛多烯體系電環化反應選擇規則可歸納如右圖。

聚合反應
如1,3-丁二烯(CH2=CH-CH=CH2)聚合生成-[-CH2-CH=CH-CH2-]n-

雙烯合成
又稱狄爾斯-阿爾德(Diels-Alder反應)。共軛二烯烴和某些具有碳碳雙鍵、三鍵的不飽和化合物進行1,4一加成,生成環狀化合物的反應稱為雙烯合成反應。
狄爾斯一阿爾德反應是協同反應,即舊鍵的斷裂和新鍵的形成是相互協調地在同一步驟中完成的。在光照或加熱的條件下,反應物分子彼此靠近,互相作用,形成一個環狀過渡態,沒有活潑中間體如碳正離子、碳負離子和自由基的產生,然後逐漸轉化為產物分子。
(1)雙烯體(共軛二烯)是以s一順式構象進行反應的,雙烯體可以是鏈狀,也可以是環狀。
(2)親雙烯體的雙鍵碳原子上連有拉電子基團時,反應易進行。常見的親雙烯體有:
CH2=CH-CHO、CH2=CH-COOH、
CH2=CH—COCH3、CH2=CH-NO2、CH2=CH—CN、
CH2-CH-COOCH3、CH2=CH-CH2C1。
(3)狄爾斯一阿爾德反應具有很強的區域選擇性。當雙烯體與親雙烯體均有取代基時,兩個取代基處於鄰位或對位的產物占優勢。當雙烯體1號位有推電子基,親雙烯體上有拉電子基時,產物以兩取代基處在鄰位為主:
CH2=CH-CHO、CH2=CH-COOH、
CH2=CH—COCH3、CH2=CH-NO2、CH2=CH—CN、
CH2-CH-COOCH3、CH2=CH-CH2C1。
(3)狄爾斯一阿爾德反應具有很強的區域選擇性。當雙烯體與親雙烯體均有取代基時,兩個取代基處於鄰位或對位的產物占優勢。當雙烯體1號位有推電子基,親雙烯體上有拉電子基時,產物以兩取代基處在鄰位為主:

當雙烯體2號位有推電子基,親雙烯體上有拉電子基時,產物以兩取代基處在1,4位為主:

(4)狄爾斯一阿德爾反應是一個可逆反應。通常正向成環反應的反應溫度相對較低,提高反應溫度則發生逆向的分解反應。利用這種可逆性,既可以作為提純雙烯化合物的一種方法,也可以用來製備少量不易保存的雙烯體,例如,實驗室少量使用1,3一丁二烯時可用環己烯加熱分解來製備。此外,可利用其逆反應分離有機物以及有機反應基團的保護等。
(5)狄爾斯一阿德爾反應的產量高,套用範圍廣是現代有機合成反應中非常重要的碳碳鍵形成的方法,在理論和生產上都占有重要的地位。
合成方法進展
1.以烯丙基二硫縮醛為原料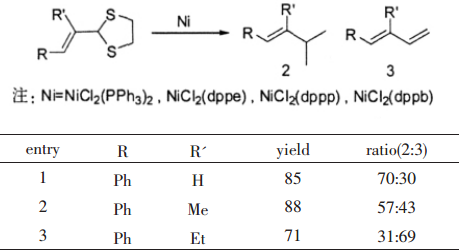

早在1988年,YangPingfan等人就報導了Ni催化的烯丙基二硫縮醛的偕二甲基化作用,該反應生成的是兩到三種的產物,文獻報導當R'的取代基從H到甲基到乙基,目標產物共軛二烯的產率呈上升趨勢。
2.以N-烯丙基腙的衍生物為原料

2008年,Devon等人報導了一種從醛和N-烯丙基腙的衍生物出發立體選擇性合成二烯的新方法,收率達到了80%以上。他們先後發表了兩個合成路線,第一條路線是用CuCl2做催化劑,得到反式的共軛二烯,收到較好效果,為了找出反應取得立體選擇性的關鍵步驟,他們在此之後設計了第二種方法:NBS做催化劑的一鍋法。反應過程中原料不需要被分離提純,反應經歷了濃縮-溴化-消除三個步驟,適用範圍廣泛,且克服了許多反應需要過量其中一種底物使反應完全的要求。但脂肪族的醛得到的是混合產物,所以具有一定的局限性。
3.以醇為原料

2008年,Michae等人[6]報導了用Cu催化的氧化-烯化多步反應,本路線採用了一種簡單有效的Cu催化劑,對一級醇和二級醇都有效,該反應不會發生異構化,也可以通過該反應合成炔烯化合物,同時該反應也適用於脂肪族醇,烯丙基苯甲基二級醇(生成二取代的烯)。該反應的優點在於採用了簡單經濟的催化體系和並不苛刻的反應條件對敏感的易烯醇化的底物依然有效,反應對底物官能團的要求低,可以適應於大量的醛酮。但是由於是兩步反應,操作步驟比較繁瑣。
4.Suzuki交叉偶聯反應
4.1.烯丙基三氟硼酸鉀的交叉偶聯反應
4.1.烯丙基三氟硼酸鉀的交叉偶聯反應

Pd催化的偶聯反應已經廣泛套用於C-C鍵的形成[7]。Pd催化的烯丙基三氟硼酸鉀和鹵代芳基或烯烴的新型Suzuki交叉偶聯反應,於2009年由Gary等人[8]提出。傳統的Suzuki交叉偶聯反應是使用BH3做有機金屬衍生物,如今已經被廣泛套用於生產,但是這條路線有其缺陷和不足:首先,硼酸容易二聚和三聚環化生成硼酸酐和環硼氧烷,這就使定量分析產生了困難;其次,硼酸容易水解且後處理較難。三氟硼酸鉀代替硼酸後,克服了傳統工藝的缺陷,產生的副產物是無機的,低毒的,環境保護性好並且較易後處理,原料有機三氟硼酸的製備經濟簡單,是由KHF2製備而得,KHF2是一種便宜的氟化物來源,且具有其他有機硼試劑更強的親核性,有較強的空氣穩定性,可以通過結晶直接分離得到,適合工業化生產。
4.2.烯丙基三烷氧基矽的交叉偶聯反應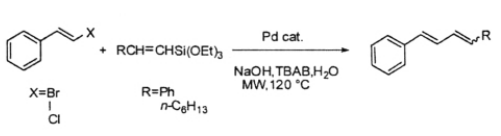

2007年,EmilioAlacid等人[9]提出了烯丙基三烷氧基矽和苯乙烯鹵化物的交叉偶聯反應。烯丙基三烷氧基矽是由相應的炔和三烷氧基矽用金屬銠催化得到,操作較簡便。產物沒有立體選擇性,有機矽化物具有高穩定性,低毒性,高回收率,可適用於工業化大生產。
5.醛的Wittig烯化反應
RuiTamura等人[10]在1987年報導了Wittig反應合成共軛二烯的方法,通過醛和磷的內鎓鹽的烯化作用,該反應對內鎓鹽的類型和條件有較高要求,反應先要合成內鎓鹽,是烯丙基磷酸鹽用n-BuLi或t-BuLi在THF中處理,然後再加入醛酮而得。適用範圍廣,芳香、脂肪族二烯均有效,但收率不是很高,且不具有立體選擇性。且需要大量過量的原料也使該反應在工業化套用中受到一定的局限。
6.以酮為原料

Hélène等人[11]提出了銠催化得到共軛二烯的方法。該反應克服了Wittig反應需要過量原料的缺點,有更高的收率,上式的反套用Wittig法可以得到的收率是79%。但是對帶吸電子基團的酮收率一般,醛無法反應,局限性太大。
套用
以丁二烯和異戊二烯為代表的碳四及碳五餾分用途越來越廣泛。丁二烯是C4餾分中最重要的組分之一,在石油化工烯烴原料中的地位僅次於乙烯和丙烯。C5餾分中最具有利用價值的是異戊二烯、間戊二烯、和環戊二烯三種共軛二烯烴,其中異戊二烯是主要產品之一。作為典型的共軛二烯烴,丁二烯和異戊二烯是合成橡膠的主要原料單體,通過聚合反應生成不同性能的橡膠,下圖列出了這兩種典型共軛二烯烴聚合反應的重要產物。