簡介 生物體本身就是一個神秘而精密地高效運作的機器。大到各系統之間,小到每個細胞,無一不展示著生命的神奇,他們之間的配合是那樣的天衣無縫。繼內含子的自我剪接功能發現之後,第一個內含肽——命名為Sce VMA1 發現了,它的發現使內含肽陸續在各種生物中發現,它們在單細胞真核生物、真細菌、古細菌、噬菌體和病毒的基因組中均有分布. 自我剪接機制的發現為蛋白質工程提供方便,尤其是對蛋白質的提純方面,是一個開創性的突破。與傳統的蛋白質提純相比存在許多優勢,成本低而且快捷。下面對內含肽的結構與功能做一些簡單的介紹。
結構 被人們公認的標準內含肽的結構模體為:N端剪接區+中部歸巢核酸內切酶區域+ C剪接區域 。兩端剪接區參與蛋白質的剪接,中部區域參與蛋白質歸巢過程,少數內含肽不含核酸內切酶區域。全功能型內含肽包括8個保守區或基序,一般由244~1650個胺基酸鹼基組成,大部分在500個胺基酸殘基左右。自導引歸巢核酸內切酶將剪接功能區分為含有A和B保守區的N端和含有G和F的C端功能區。從N端開始到C端依次為A、B、C、D、E、H、F、G,其中C、D、E、H屬於自導引歸巢核酸內切酶家族。微型內含肽均帶有A、B、F、G保守區,一般由128~1309個胺基酸殘基組成,大部分為160個左右胺基酸殘基自導引歸巢核酸內切酶(Homing endonuclease)活性在識別序列和功能上與核酸內含子(Intron)的自導引歸巢核酸內切酶類似,具有位點特異性,可以在無Intein等位基因的雙鏈DNA位點定點切割,引起Intein的插入。N端和C端的序列高度保守;絕大多數內含肽均以Ser/Cys作為N端起始胺基酸,以Asn作為C端末位胺基酸,包含了剪接過程的所有信息.。僅有兩種內含肽的C端為Gln。90% 的內含肽c端的倒數第二個殘基為His,其作用是輔助相鄰的末位Asn環化天冬醯胺的環化是內含肽剪接過程中關鍵的一步,其過程是不可逆的。
種類 從內含肽的內部有無自導引歸巢核酸內切酶結構域,可將內含肽分為2種類型。一種是全功能型內含肽(maxi—intein),具有蛋白剪接活性和自導引核酸內切酶序列(homingendonuclease);另一種是微型內含肽(mini—intein),只有蛋白剪接活性。其中自導引歸巢核酸內切酶結構域的缺失在SceVMAI內含肽、SspDnaB內含肽及MtuRecA內含肽中不影響蛋白剪接的活性,在PspPol—I內含肽中則可導致剪接活性的缺失。在天然狀態下MxeGyrA中則直接形成微型內含肽,並不影響剪接活性
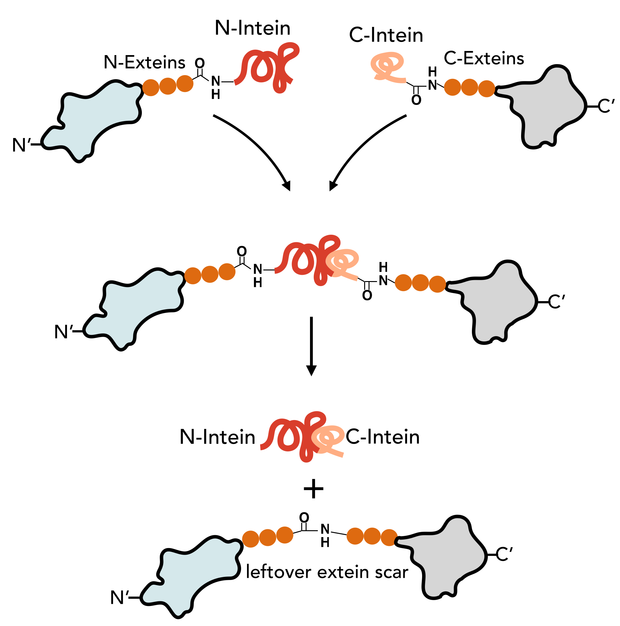
根據其的存在形式,分為整體內含肽和分離內含肽。前者的兩個剪接區域共同存在於同一多肽片段上,後者的兩個剪接區域分裂成兩份或者更多片段,存在於不同的多肽片段上,所以成為分離內含肽。整體內含肽進行順式剪接作用,分離內含肽進行反式剪接作用。內含肽具有蛋白質和核酸兩種水平上的含義,指插入宿主蛋白質中的多肽序列和對應的核苷酸序列。反式剪接的是一種特殊的剪接通常發生在微小內含肽之間按。這個微小內含肽的N端和C端剪接結構域的基因被750kb的基因組序列分開,且分別位於相反的DNA鏈上。
作用機制 內含肽剪接是一個快速、高效的反應過程,前體蛋白在細胞中幾乎分離不到。反應亦不需要任何輔助因子、酶和ATP能量,其催化結果是將內含肽兩側的外顯肽通過肽鍵連線成成熟的天然肽。。基於剪接位點胺基酸殘基的化學性質以及帶分支的剪接中間產物分子的發現,人們提出了多種假說來描述這一反應過程。目前被普遍接受的剪接機制可以拆解為以下四步
(1)N—x醯基轉移(X=0,s) 內含肽起始胺基酸Ser/Cys的側鏈基團一OH/一SH向前一位胺基酸殘基的羰基發動親核攻擊,產生N一0或N—s的醯基重排,打破原來的肽鍵而代之以(硫)酯鍵,將N一外顯肽轉移到內含肽第一個殘基的側鏈上。在中性pH條件下,醯胺一硫酯平衡通常是有利於醯胺鍵形成的。但是,含有內含肽的前體蛋白的晶體結構顯示,位於上游剪接點的肽鍵在構象能級上處於不利的地位。用其他胺基酸殘基替代內含肽N端的SedCys會完全阻斷該剪接位點肽鍵的斷裂。
(2)轉酯:內含肽N端的(硫)酯鍵在C端外顯肽首位胺基酸Cys/SedThr側鏈一OH/一SH基團的親核替代作用下發生斷裂,將N.端外顯肽序列從內含肽的N端轉至C端外顯肽起始胺基酸側鏈上,形成分支中間體。該反應在鹼性條件下(pH9—10)可發生逆轉,由分支中間體變回線性前體 。
(3)Asn/Gln環化 Asn的側鏈基團一N 對其自身的羰基發動親核攻擊,使Asn形成氨基琥珀酸五元環結構,同時內含肽與C端外顯肽之間的肽鍵斷裂。在此步反應中,內含肽被釋放出來。與前幾步反應不同的是,Asn/Gln的環化基本上是不可逆的。若用其他胺基酸取代Asn/Gln,則會完全阻斷內含肽C端肽鍵的裂解反應,但並不影響上步反應中(硫)酯鍵中間產物的形成。內含肽C端倒數第二位的His可以輔助與之相鄰的Asn的環化,其突變也會影響C端肽鍵的裂解反應。值得注意的是,前兩步反應似乎並不是第三步C端肽鍵的裂解反應必要前提。因此可採用將靶蛋白直接與內含肽C端融合的方法進行蛋白質的純化和重組 。
(4)外顯肽的連線 連線的兩個外顯肽的(硫)酯鍵自發進行的轉醯基反應,以更穩定的醯胺肽鍵取代(硫)酯鍵,將N端C端外顯肽用天然肽鍵連線起來。
套用 內含肽序列加上C端外顯肽的第一個胺基酸殘基包含了蛋白剪接的全部信息,甚至可以介導非“原配”的外源蛋白質的剪接。內含肽與上游和下游的外顯肽序列之間幾乎沒有同源性,所以,如果外源目的蛋白替換天然外顯肽,內含肽仍然可以保持剪接活性。但是利用好這一特點對蛋白質人工剪接需要考慮一些影響因素:外源蛋白及剪接位點附近胺基酸殘基的變化、表達宿主的不同以及反應條件(溫度、pH、誘導試劑)的不同。合理地利用這些影響因素可以有效地進行剪接控制。
分離純化 內含肽具自切割特性的這種特性而實現目標蛋白與親和標籤分離的目的。內含肽在蛋白質純化中的套用修飾後(位點特異性突變)的內含肽經誘導能夠介導N端或C端單側肽鍵斷裂。首先將編碼親和標籤、內含肽及目標蛋白的基因序列連線在一起,在合適的宿主系統中表達出一個標籤-內含肽-目標蛋白的三聯體,利用修飾後的內含肽構建的蛋白純化載體可以將目的蛋白直接融合表達於內含肽的N端或C端,幾丁質結合域(chitin binding domain,CBD,5kDa,環狀芽孢桿菌)融合表達於內含肽的另一端或內部。當這個“三元”融合蛋白複合物流經結合有幾丁質的親和純化柱時,再利用固定在樹脂上的配體吸附三聯體的標籤而截留融合蛋白,隨後在某些簡單的理化因素作用下(如pH、溫度的變化或者巰基化合物的加入)該三聯體從內含肽的N一端或者C端端發生自切割釋放目標蛋白,而此內含肽與CBD的複合物結合在親和純化柱上,目的蛋白直接洗脫下來。
傳統的親和純化方式是指利用基因融合技術將親和標籤和目標蛋白進行融合表達質,再依靠親和標籤與固定化的配體之間的特異性吸附作用實現目標蛋白的分離純化。通常情況下,通過親和層析得到的融合蛋白,需再經過蛋白酶的水解用移除親和標籤以得到純化的目標蛋白質。在實驗室規模的套用中,親和純化方式有著簡單而方便的優點,但也存在著一些缺陷。一方面,為了消除親和標籤常常需要外加蛋白酶。儘管設計之初在融合標籤與目的蛋白質之間引入了能夠被蛋白酶特異性識別並切割的連線片段, 但仍然存在著目標蛋白質被意外切割的情況:再者,後期對蛋白酶的清除過程以及蛋白酶本身較高的價格也增加了蛋白質純化的成本。另一方面,親和樹脂及緩衝液的高製造成本也進一步加大了蛋白質純化的代價, 而在大規模的生產套用中, 成本因素往往是必須考慮的一個重要方面。
以內含肽為基礎的蛋白純化技術的優越性在於:不需要使用昂貴的蛋白酶進行蛋白裂解;裂解僅發生在剪接位點,與目的蛋白上的蛋白酶敏感位點無關,避免了蛋白酶對目的蛋白的降解;蛋白純化和內含肽活性的誘導均可直接在親和純化柱上進行;最為重要的是,內含肽介導的蛋白質純化不會對蛋白質的生物學活性產生影響。
內含肽介導的蛋白連線(intein—mediated protein ligation,IPL)
通過改變裂解條件以及對內含肽進行適當修飾,可以生物合成c端帶有硫酯鍵或N端帶有半光氨酸的蛋白質分子。兩種蛋白質混合以後,硫酯鍵和半光氨酸利用“自然化學連線”(native chemical ligation)的原理進行自發的連線反應,在硫酯和半光氨酸之間形成肽鍵,從而將兩種蛋白質連線起來。自然化學連線是從蛋白質半合成研究中發展起來的技術 ,其基本原理是,C端帶有硫酯的合成肽與N端帶有半光氨酸的合成肽或蛋白質混合後,硫酯和半光氨酸之間會發生高效的化學選擇性反應,形成的硫酯鍵將兩個蛋白質分子連線起來,隨後的S- N的醯基重排將硫酯鍵轉變為肽整個過程除了沒有發生Asn的環化以外,與內含肽的作用機理基本一致。但是,自然化學連線法不能在細胞中表達C末端硫酯蛋白,而且固相合成的肽鏈長度也有限。
斷裂型內合肽介導的蛋白質環化
環化蛋白質具有3個明顯的特性:①提高穩定性和活性,這是由於環化的蛋白質可以減少非摺疊狀態的構象熵值;②摺疊速度快,這是因為其減少了摺疊途徑的數目的緣故;③對N端和C端特異性的蛋白酶具有抗性,因此能改善在體內的穩定性。由於以上特性,環化蛋白質在蛋白質工程和醫藥工業中備受重視。以IMPACT~TWIN(NEB公司產品)和SICLOPPS為代表的2種載體分別被構建,用於體外和體內環化蛋白。IMPACT一rWIN用於表達“N端內含肽一靶蛋白一C端內含肽”形式的融合蛋白。在體外純化後,經pH及巰基誘導切割此產物產生N端的半胱氨酸和C端的巰酯鍵,在低濃度下有利於靶蛋白分子內末端連線反應形成環狀分子,而在高濃度下則促進分子之間末端的連線,從而產生串聯的多聚產物,然後通過內含肽介導的連線方式(intein—mediatedproteinligation,IPL)由N端半胱氨酸攻擊C端巰酯鍵。天然存在的SspDnaE斷裂型內含肽兩端片段具有很強的親和性,靶蛋白基因被插入C端和N端之間形成一個三明治結構,經剪接後靶蛋白的N端和C端在體內通過正常的肽鍵連線而產生環化產物。相對於體外環化系統來說,目的蛋白在體內不須化學處理在細胞內進行自我環化反應,因此具有廣泛的套用價值。通過控制溫度表達DnaE內含肽也可以在體外環化蛋白,以便純化產物。除了SspDnaE以外,PI—PfuI和RecA內含肽也得到成功套用。
內含肽剪接調控以作為藥物“開關”
含肽作為藥物靶標的研究於內含肽這種可調控的作用機制,Bonnanl51為,通過改變剪接結構域上、下游的序列,自主設蛋白質內含肽,可以調控蛋白質的剪接。因為包含內含肽的前體蛋白無活性的,所以那些能阻斷剪接的化學物質將具有重要的藥用價值。由於目前在動物和人體正常新陳代謝中沒有發現內含肽的報導,作為藥靶標的內含肽將不大可能有毒副作用。
內含肽可作為抗結核分支桿菌藥物靶標
由於肺結核的復發率高,且病菌對抗生素耐藥具有適應性,針對結核分支桿菌(Mycobacteriumtuerculosis)的快速而獨特的診斷工具就顯得非常需要。分支桿菌是通過內含肽的作用影響人類的相關病,如結核、麻風病。在肺結核的發生中,DNA編碼RecA和DnaB這兩個蛋白質起重要作用,RecA和DnaB均需通過內含肽的剪接才能成為致病的功能蛋白。套用突變試劑或生長抑制劑,干涉
蛋白質剪接 ,RecA和DnaB將失去致病的功能。對結核分桿菌來說,鑲嵌有內含肽的蛋白質RecA和DnaB一定條件下將是有毒的,它們能引起結核分支桿生長抑制和死亡。如果通過某些潛在抑制劑的研發,直接調控RecA和DnaB的剪接過程。該抑制劑是針對受染組織或致病菌的DecA和DnaB的剪接過程,抑制致病毒蛋白的成熟,從使結核分支桿菌喪失致病功能,這樣內含肽可成抗結核分支桿菌的藥物靶標。另外,由於RecA、DnaB的內含肽在結構上非常接近,如果用多種製劑的組契約時作用於RecA和DnaB的內含肽剪接過程,將比單獨調控RecA或DnaB的內含肽剪作用更有效。
內含肽可作為治療線粒體疾病藥物靶標
粒體DNA(mtDNA)突變,將導致mtDNA編碼、與氧化磷酸化有關的13種蛋白質的突變,從而起很多罕見的疾病,這也可能是人類衰老的原因之一。由於該13種蛋白質高度的疏水性,通過轉基編碼表達的有生物活性的蛋白質很難從細胞質中進入線粒體。根據內含肽的作用機制,首先在胞質合成線粒體目標蛋白前體片段序列,該序列無生物活性,但包含引導序列和內含肽相應的c端或N剪接結構域的保守胺基酸殘基,當序列進入線粒後,引導序列被降解,c端與N端的特異胺基酸通轉酯作用,形成包含內含肽序列的前體蛋白質,最後通過內含肽介導的剪接作用,線上粒體基質中形有活性的蛋白質,從而達到治療線粒體疾病的作用。
蛋白剪接作為一種發生在翻譯水平而非轉錄水平的生物大分子成熟形式,進一步增加了蛋白質生物合成機制的複雜性。
事實上,人們還不清楚內含肽存在的真正的生物學意義。但有理由相信,隨著內含肽研究的深入,內含肽相關技術的套用會得到更廣的重視和發展。