傅列德爾-克拉夫茨反應,簡稱傅-克反應,是一類芳香族親電取代反,1877年由法國化學家查爾斯.傅列德爾(Friedel C)和美國化學家詹姆斯·克拉夫茨(Crafts J)共同發現。該反應主要分為兩類:烷基化反應和醯基化反應。常用的催化劑有氯化鋁、氯化鐵、氯化鋅、三氯化硼,其中氯化鋁的活性最高。當反應中苯環上連有強吸電子基團,如硝基、磺酸基、醯基和氰基時,不發生此反應。
基本介紹
- 中文名:傅列德爾-克拉夫茨反應
- 外文名:The reaction of Friedel - crafts
- 簡稱:傅克反應
- 發現時間:1877年
- 套用學科:有機化學
- 反應類型:取代反應
基本性質,反應機理,分類,傅-克烷基化反應,傅-克去烷基化反應,傅-克醯基化反應,傅-克羥基烷基化,套用,合成染料,檢測芳香烴類,拓展,
基本性質
1、在烷基化反應中用三個以上碳原子的直鏈伯鹵代烷的烷基化試劑時,特點為:
①烷基化反應親電試劑為碳正離子,有重排現象,故烷基化產物有異構化現象;
②烷基化反應為可逆反應故烷基苯可進行歧化反應即一分子烷基苯脫烷基變成苯另一分子烷基苯增加烷基變成二烷基苯;
③生成的烷基苯更容易進行烷基化反應故烷基化反應能生成多元取代產物;
④苯環上有強吸電子基如硝基、磺基時不易發生烷基化反應。
2 、常用的醯基化試劑有,醯鹵、醯酐和羧酸。醯基化反應催化劑的作用是形成醯基碳正離子,特點為:
①醯基化反應不發生醯基異構現象;
②醯基化反應不能生成多元醯基取代產物;
③醯基化產物含有羰基能與路易斯酸絡合消耗催化劑催化劑用量一般至少是醯化試劑的二倍。 苯環上有強吸電子基時不發生醯基化反應。
反應機理
第一步是在路易斯酸的條件下,氯的解離形成醯基碳正離子:

第二步是接下來的芳環親電試劑進攻醯基正離子:

最後一步,電荷轉移至氯原子形成HCl,而AlCl3催化劑重新形成:

分類
傅-克烷基化反應
在強路易斯酸的催化下使用鹵代烴對一個芳環進行烷基化。假設使用無水氯化鐵作為催化劑,在氯化鐵的作用下,鹵代物產生碳正離子,碳正離子進攻苯環並取代環上的氫,最後產生烷基芳香族化合物和氯化氫。
總反應式如下:

缺點:由於烷基側鏈的供電性,反應產物比起原料具有更高的親核性,於是產物苯環上的另一個氫繼續被烷基所取代,導致了過烷基化現象而形成了眾多副產物。由於這類反應是可逆的,還可能出現烷基被其他基團所取代的副產物(例如被氫取代時,也稱為傅-克脫烷基化反應);另外長時間的反應也會導致基團的移位,通常是轉移至空間位阻較小、熱力學穩定的間位產物。另外如果氯不是處於三級碳原子(叔碳原子)上,還有可能發生碳正離子重排反應,而這取決於碳正離子的穩定性:即三級碳>二級碳>一級碳。 空間位阻效應可以被利用於限制烷基化的數量,比如1,4-二甲氧基苯的叔丁基化反應。
 1,4-二甲氧基苯的叔丁基化
1,4-二甲氧基苯的叔丁基化烷基化的底物並不局限於鹵代烴類,傅-克烷基化可以使用任何的碳正離子中間體參與反應,如一些烯烴,質子酸,路易斯酸,烯酮,環氧化合物的衍生物。如合成1-氯-2-甲基-2-苯基丙烷就可以從苯與3-氯-2-甲基丙烯進行反應:
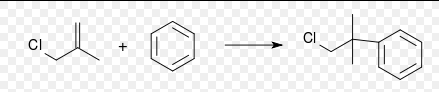 1-氯-2-甲基-2-苯基丙烷的合成
1-氯-2-甲基-2-苯基丙烷的合成傅-克去烷基化反應
是一個可逆反應:在逆向傅-克反應或者稱之為傅-克去烷基化反應當中烷基可以在質子或者路易斯酸的存在下去除。
例如,在用溴乙烷對苯的多重取代當中,由於烷基是一個活化基團,原來期待能夠得到鄰對位取代的產物。然而真正的反應產物是1,3,5-三乙基苯,即所有烷基取代都是間位取代。熱力學反應控制使得該反應產生了熱力學上更穩定的間位產物。通過化學平衡,間位產物比起鄰對位產物降低了空間位阻。因此反應最終的產物是一系列烷基化與去烷基化共同作用的結果。
 1,3,5-三乙基苯的合成
1,3,5-三乙基苯的合成傅-克醯基化反應
在強路易斯酸做催化劑條件下,讓醯氯與苯環進行醯化的反應。此反應還可以使用羧酸酐作為醯化試劑,反應條件類似於烷基化反應的條件。醯化反應比起烷基化反應來說具有一定的優勢:由於羰基的吸電子效應的影響(鈍化基團),反應產物(酮)通常不會像烷基化產物一樣繼續多重醯化。而且該反應不存在碳正離子重排,這是由於醯基正離子可以共振到氧原子上從而穩定碳離子(不同於烷基化形成的烷基碳正離子,正電荷非常容易重排到取代基較多的碳原子上),生成的醯基可以用克萊門森還原反應、沃爾夫-凱惜納-黃鳴龍還原反應或者催化氫化等反應轉化為烷基。
 條件:氯化鋁為催化劑,回流,無水
條件:氯化鋁為催化劑,回流,無水傅-克醯化的成功與否取決於醯氯試劑的穩定性。比如甲醯氯就由於不穩定而不能進行,因此合成苯甲醛就需要其他的方法,如Gattermann-Koch反應:在氯化鋁和氯化亞銅的催化下,通過苯、一氧化碳與氯化氫在高壓當中合成。
傅-克羥基烷基化
套用
合成染料
傅克反應套用於很多染料的合成,比如:三苯基甲烷和氧雜蒽染料。下圖通過兩當量的百里酚和鄰苯二甲酸酐合成百里酚酞(一種pH指示劑)。
 百里酚酞的合成
百里酚酞的合成下圖通過鄰苯二甲酸酐和間苯二酚在氯化鋅的催化下得到氟代螢光素。而在反應中用N,N-二乙基氨基酚取代間苯二酚做則得到羅丹明B:
 羅丹明B的合成
羅丹明B的合成檢測芳香烴類
利用氯仿和氯化鋁催化劑和芳香化合物反應得到三芳香環取代甲烷,由於通常具有亮麗的顏色這種反應能夠用來在實驗室內檢驗芳香化合物。
拓展
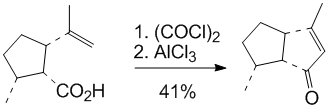
如同克萊森重排的發展一樣,傅-克醯基化反應先是在芳香族化合物的反應中發現和套用,而後來發現該反應同樣適用於非芳香族化合物(主要是烯烴)。比如環己烯與乙醯氯在三氯化鋁的作用下生成共軛環己烯基酮,而這個方法已經發展為一種重要的合成共軛不飽和酮的方法。

比如在天然產物kelsoene的一種合成方法中就利用了分子內非芳香傅克反應: