基本介紹
- 中文名:偏鋁酸鉀
- 外文名:potassium metaaluminate
- 化學式:KAlO2
- 狀態:常溫下為白色固體
- 相對分子質量:約為98
- 水溶性:可溶於水
- 組成離子:鉀離子、偏鋁酸根離子
- 溶液酸鹼性:鹼性
- 溶解性:可溶於水
生成,化學性質,強酸反應,二氧化碳反應,鋁離子反應,碳酸氫根離子,生成明礬,水解,反應實質,舊認識更正,
生成
2Al+2KOH+2H2O=2KAlO2+3H2↑

偏鋁酸鉀的結構式
Al(OH)3+KOH=KAlO2+2H2OAl2O3+2KOH=2KAlO2+H2O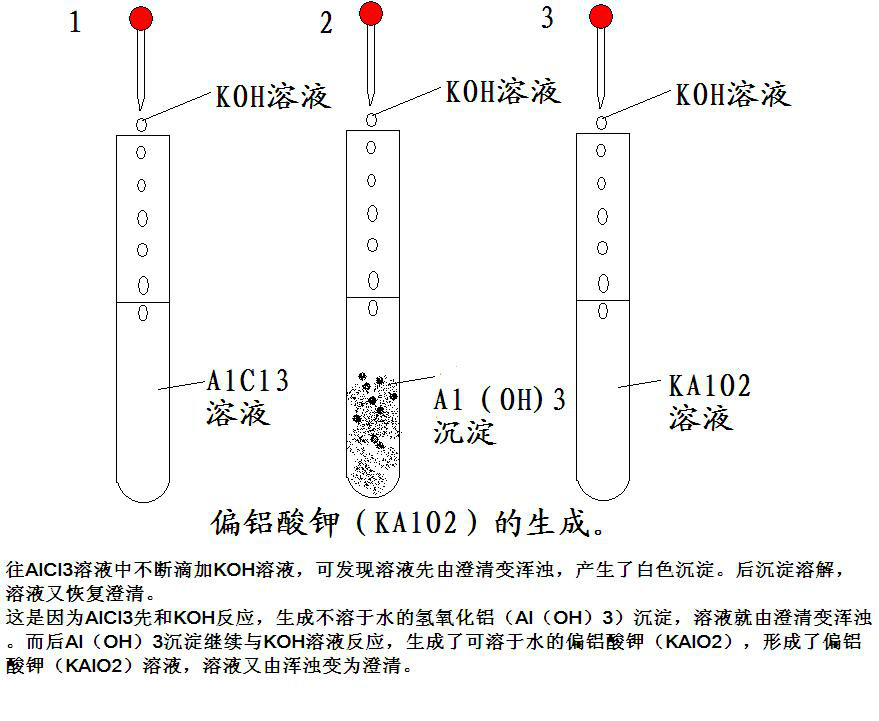

偏鋁酸鉀的生成
2、偏鋁酸鉀還可以由鋁鹽加過量氫氧化鉀生成
AlCl3+4KOH=KAlO2+3KCl+2H2O
化學性質
由於偏鋁酸鉀和偏鋁酸鈉都含有偏鋁酸根離子,故而,偏鋁酸鉀的很多化學性質與偏鋁酸鈉類似,比如與強酸反應,和二氧化碳反應,與鋁離子反應。其中,參與這些反應的是偏鋁酸根離子,鉀離子不參加反應。
而因為偏鋁酸根是弱酸根,所以偏鋁酸根會水解,故而偏鋁酸鉀溶液呈鹼性。
強酸反應
偏鋁酸鉀溶液可以與強酸(比如鹽酸等)反應,生成氫氧化鋁,如果強酸過量,還可生成鋁離子
KAlO2+HCl+H2O=Al(OH)3↓+KCl
KAlO2+4HCl=AlCl3+2H2O+KCl
二氧化碳反應
偏鋁酸鉀溶液與二氧化碳發生反應,生成碳酸鉀和氫氧化鋁。但是,氫氧化鋁並不和二氧化碳反應,但碳酸鉀會和二氧化碳繼續反應,生成碳酸氫鉀。故而,在二氧化碳適量時,生成的是氫氧化鋁和碳酸鉀,二氧化碳過量時,生成氫氧化鋁和碳酸氫鉀
2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3(二氧化碳適量)
KAlO2+CO2+2H2O=Al(OH)3+KHCO3(二氧化碳過量)
鋁離子反應
偏鋁酸鉀會和鋁離子發生雙水解反應,生成氫氧化鋁
AlCl3+3KAlO2+6H2O=4Al(OH)3↓+3KCl
碳酸氫根離子
偏鋁酸鉀不僅僅會和鋁離子反應,和碳酸氫根離子也會發生類似強酸制弱酸的反應(碳酸氫根將它的氫給偏鋁酸根,自己形成碳酸根,這是一個單方給予的過程;而雙水解則是一個從水那裡各取所需的過程),二者在溶液中不能共存。比如偏鋁酸鉀會和碳酸氫鉀發生化學反應,生成碳酸鉀和氫氧化鋁。偏鋁酸鉀和碳酸氫鉀的反應方程式為:
KAlO2+KHCO3+H2O=Al(OH)3↓+K2CO3
由於鉀離子實際上並不參加反應,參加反應的是偏鋁酸根離子,故而,該反應化為離子方程式為:

證明:因為碳酸的二級電離常數為:

而氫氧化鋁的酸式溶度積常數為:

而由於偏鋁酸鉀和碳酸氫鹽(如碳酸氫鉀)反應的化學平衡常數為

常數較大,反應顯然能發生。
同理,偏鋁酸鉀還會和亞硫酸鉀、磷酸二氫鉀反應,故而偏鋁酸鉀與碳酸氫鹽(如碳酸氫鉀(KHCO3))、亞硫酸氫鹽溶液(如亞硫酸氫鉀(KHSO3))、磷酸二氫鹽溶液(如磷酸二氫鉀(KH2PO4))都不能共存於同一溶液中。但是,偏鋁酸鉀可以和碳酸根共存於同一溶液中。
生成明礬
在偏鋁酸鉀溶液中加入過量濃硫酸,可生成溶解度較小的復鹽明礬(KAl(SO4)2·12H2O)。反應式為:

故該反應可用於製備明礬。
水解
由於偏鋁酸鉀中的偏鋁酸根是弱酸根離子,故而偏鋁酸鉀可在水中發生水解,參與水解的是偏鋁酸根離子,鉀離子並不參加反應。
由於偏鋁酸根離子水解的緣故,偏鋁酸鉀溶液呈鹼性。反應方程式為(註:該反應可逆):

反應實質
在關於偏鋁酸鉀的很多反應中,由於鉀離子不參與反應,故而參與反應的實際上是偏鋁酸根離子。
與強酸發生反應: (註:上面的反應是酸適量時發生,下面的反應是酸過量時發生)
(註:上面的反應是酸適量時發生,下面的反應是酸過量時發生)

與弱酸H2CO3發生反應,即通入CO2氣:
∵Al(OH)3酸性<H2CO3,且Al(OH)3酸性<

∴反應為: (註:上面的反應是CO2適量時發生,下面的反應是CO2過量時發生)
(註:上面的反應是CO2適量時發生,下面的反應是CO2過量時發生)

與鋁離子反應:鋁鹽和偏鋁酸鹽溶液互促水解反應

舊認識更正
人教版教材中編寫道:氫氧化鋁溶於氫氧化鈉溶液生成偏鋁酸鈉溶液,而後來的山東科學技術出版社出版的化學教材(必修一)中,講到鋁和其金屬材料一課中,說Al和NaOH和水反應生成Na[Al(OH)4]四羥基合鋁酸鈉。這是怎么一回事呢?實際上,偏鋁酸鈉在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不過是為了方便,把它簡寫成NaAlO2。但它的實際組成還是Na[Al(OH)4]。

偏鋁酸鉀
不僅僅是偏鋁酸鈉,偏鋁酸鉀等其它偏鋁酸鹽也類似。偏鋁酸根在水溶液中是以四羥基合鋁酸根的形式存在,只不過為了方便,才把它寫成偏鋁酸根的形式,但偏鋁酸鹽的實際組成仍是四羥基合鋁酸根。
因此,根據上述結論,偏鋁酸鉀在水溶液中也是以四羥基合鋁酸鉀( )的形式存在,為了書寫方便,故而把四羥基合鋁酸鉀仍舊寫成了偏鋁酸鉀(KAlO2),但偏鋁酸鉀在溶液中的實際組成仍然是四羥基合鋁酸鉀。真正的偏鋁酸鉀只能在熔融狀態下存在。
)的形式存在,為了書寫方便,故而把四羥基合鋁酸鉀仍舊寫成了偏鋁酸鉀(KAlO2),但偏鋁酸鉀在溶液中的實際組成仍然是四羥基合鋁酸鉀。真正的偏鋁酸鉀只能在熔融狀態下存在。


