基本介紹
- 中文名:柏吉尤斯加氫法
- 外文名:Bergerius Process
- 發明者:柏吉尤斯
- 發明時間:1913
- 學科:燃料化學
- 別名:煤直接液化法、煤加氫還原法
煤直接液化法,反應機理,工藝流程,發展,IGOR工藝,HTI工藝,NEDOL工藝,中國研究進展,柏吉尤斯簡介,
煤直接液化法
柏吉尤斯加氫法是煤利用的第一個商業化液化過程,在1911年就在德國開發,1913年成功發明,在第一次世界大戰期間已經在商業規模下進行。該過程涉及將煤混合在從以前的液化回收的油中,然後使用氧化鐵催化劑,將混合物與氫氣在高壓範圍從200到700個大氣壓下反應。 該反應的反應器溫度在425-480℃(800-900°F)的範圍內。 輕質和重質液體餾分與灰分離,分別生成用於下次液化運行的汽油和油。 一般來說,柏吉尤斯加氫法利用一噸煤產生約150至170升(40至44加侖)的汽油,190升柴油和130升燃料油。
反應機理
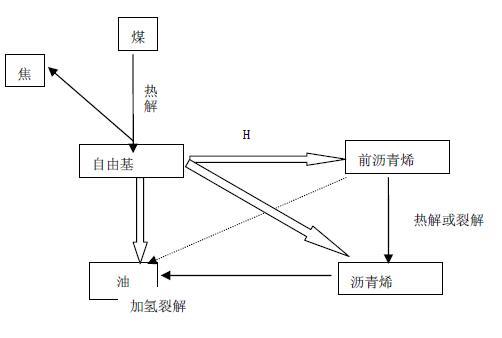
煤漿在高溫、高壓和氫氣環境下,通過催化劑的作用,發生煤加氫液化反應生成液態烴類產物,再經產品分餾得到液化輕油餾分和液化重油餾分。大量研究證明,煤在一定溫度、壓力下的加氫液化過程基本分為3 大步驟。
第一步,當溫度升至300℃以上時,煤受熱分解, 即煤的大分子結構中較弱的橋鍵開始斷裂,打碎了煤的分子結構,從而產生大量的以結構單元分子為基體的自由基碎片, 自由基的分子量在數百範圍(註:自由基的定義,由共價鍵均裂產生,自身不帶電荷,但帶有未配對電子的分子碎片)。
第二步,在具有供氫能力的溶劑環境和較高氫氣壓力的條件下, 自由基被加氫得到穩定,成為瀝青烯及液化油的分子。能與自由基結合的氫並非是分子氫(H2),而是氫自由基,即氫原子,或者是活化氫分子,氫原子或活化氫分子的來源有煤分子中的氫再分配、供氫溶劑碳氫鍵斷裂產生的氫自由基、氫氣中的氫分子被催化劑活化、化學反應放出的氫。如果系統中供給CO+H2O, 可發生變換反應(CO+H2O→CO2+H2 )放出氫。當外界提供的活性氫不足時,自由基碎片可發生縮聚反應和高溫下的脫氫反應,最後生成固體半焦或焦炭。
第三步,瀝青烯及液化油分子被繼續加氫裂化生成更小的分子。
工藝流程
煤直接液化典型的工藝過程主要包括煤的破碎與乾燥、煤漿製備、加氫液化(採用一級和二級兩個串聯反應器)、固液分離、氣體淨化、液體產品分餾和精製,以及液化殘渣氣化製取氫氣等部分。液化過程中,將煤、催化劑和循環油製成的煤漿,與氫氣混合送入反應器。在液化反應器內,煤首先發生熱解反應,生成自由基“碎片”,不穩定的自由基“碎片”再與氫在催化劑存在條件下結合,形成分子量比煤低得多的初級加氫產物。出反應器的產物構成十分複雜,包括氣、液、固三相。氣相的主要成分是氫氣,分離後循環返回反應器重新參加反應;固相為未反應的煤、礦物質及催化劑;液相則為輕油(粗汽油)、中油等餾分油及重油。液相餾分油經提質加工( 如加氫精制、加氫裂化和重整)得到合格的汽油、柴油和航空煤油等產品。重質的液固淤漿經進一步分離得到重油和殘渣,重油作為循環溶劑配煤漿用。