二噁英,實際上是一些氯化多核芳香化合物的總稱。分為多氯二苯並對二噁英(polychlorinated dibenzo-p-dioxins,簡稱pCDDs)和多氯二苯並呋喃(polychlorinated dibenzofurans,簡稱PCDFs),總的英文簡寫為PCDD/Fs,世界衛生組織(WHO)及日本等一些國家將多氯聯苯(PCBs)也列為二噁英類物質。
PCDD/Fs是一類毒性很強的三環芳香族有機化合物,由2個或1個氧原子聯接2個被氯取代的苯環組成,每個苯環上可以取0~4個氯原子,所以共有75個PCDD異構體和135個PCDF異構體。PCDD/Fs的毒性與氯原子取代的8個位置有關,人們最為關注的是2,3,7,8四個共平面取代位置均有氯原子的PCDD/Fs同系物,共有17種。其中毒性最強的是2,3,7,8-四氯代二苯並對二噁英,其毒性相當於氰化鉀(KCN)毒性的1000倍,因此被稱為“地球上毒性最強的毒物”,又因其一旦滲透到環境之中,就很難自然降解消除,故有著“世紀之毒”之稱。
這類物質既非人為生產、又無任何用途,而是燃燒和各種工業生產的副產物。由於木材防腐和防止血吸蟲使用氯酚類造成的蒸發、焚燒工業的排放、落葉劑的使用、殺蟲劑的製備、紙張的漂白和汽車尾氣的排放等是環境中二噁英的主要來源。
基本介紹
- 中文名:二噁英
- 外文名:Dioxin(s)
- 別名:二氧雜芑
- 外觀:無色無味、毒性嚴重的脂溶性物質
物質結構,理化性質,毒性,毒性作用,分子毒性作用機制,污染來源,燒結過程,垃圾焚燒,健康影響,急性致死毒性,皮膚毒性,肝毒性,致癌性,生殖毒性與內分泌干擾毒性,發育毒性和致畸性,免疫毒性,心血管系統、呼吸系統和神經系統毒性,治理方法,控制技術,改善爐內燃燒條件,煙氣處理,飛灰中PCDD的處理,分析技術,二噁英中毒事件,二噁英類CAS,標準規定,檢測標準,污染控制標準,
物質結構
二噁英是指含有2個或1個氧鍵連結2個苯環的含氯有機化合物,它的英文名字“Dioxin”。由於Cl原子在1~9的取代位置不同,構成75種異構體多氯代二苯(PCDD)和135種異構體多氯二苯並呋喃(PCDF),通常總稱為二噁英,其分子量321.96,為白色結晶體,705 ℃開始分解,800 ℃時2s完全分解。其中有17種(2,3,7,8位被Cl取代的)被認為對人類和生物危害最為嚴重。其結構如圖。
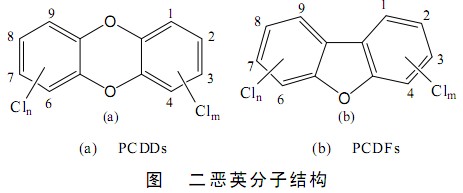
二噁英性質穩定,土壤中的半衰期為12a,氣態二噁英在空氣中光化學分解的半衰期為8.3 d,在人體內降解緩慢,主要蓄積在脂肪組織中。二噁英是一種含Cl的強毒性有機化學物質,在自然界中幾乎不存在,只有通過化學合成才能產生,是人類創造的最可怕的化學物質,被稱為“地球上毒性最強的毒物”。
理化性質
所有的二噁英在常溫下都是固體,熔點高,蒸汽壓低。它們的水溶性很低,易於吸附在顆粒物表面。隨著取代氯原子數的增加,二噁英的水溶性會降低,而在有機溶劑和脂肪中的溶解度則會增加。
同族體 | 蒸汽壓(mmHg,25℃) | Log Kow | 溶解度(mg/L,25℃) | 亨利常數 |
TCDD | 8.1*10 | 6.4 | 3.5*10 | 1.35*10 |
PeCDD | 7.3*10 | 6.6 | 1.2*10 | 1.07*10 |
HxCDD | 5.9*10 | 7..3 | 4.4*10 | 1.83*10 |
HpCDD | 3.2*10 | 8.0 | 2,4*10 | 5.14*10 |
OCDD | 8.3*10 | 8.2 | 7.4*10 | 2.76*10 |
TCDF | 2.5*10 | 6.2 | 4.2*10 | 6.06*10 |
PeCDF | 2.7*10 | 6.4 | 2.4*10 | 2.04*10 |
HxCDF | 2.8*10 | 7.0 | 1.3*10 | 5.87*10 |
HpCDF | 9.9*10 | 7.9 | 1.4*10 | 5.76*10 |
OCDF | 3.8*10 | 8.8 | 1.4*10 | 4.04*10 |
二噁英具有極強的化學穩定性和熱穩定性,常溫下以固體的形式存在,且具有較高的熔沸點,熔點的分布範圍為100~350 ℃,沸點的分布範圍為300~550 ℃,其熔沸點隨著氯取代數目的增加呈現不斷增長的趨勢,大體上具有相同氯取代數目的PCDDs熔沸點要高於PCDFs。由於二噁英的強熱穩定性,需要加熱到750 ℃左右才開始分解,大量的二噁英分解則需要加熱到950 ℃以上,而其化學穩定性表現為對光解、化學分解以及生物降解有很強的抵抗作用。
毒性
二噁英類的毒性因氯原子的取代數量和取代位置不同而有差異,含有1-3個氯原子的被認為無明顯毒性;含4-8個氯原子的有毒,其中2,3,7,8-四氯代二苯並對二噁英(2,3,7,8-TCDD)是迄今為止人類已知的毒性最強的污染物,國際癌症研究中心已將其列為人類一級致癌物;如果不僅2,3,7,8位置上被4個氯原子所取代,其他4個取代位置上也被氯原子取代,那么隨著氯原子取代數量的增加,其毒性將會有所減弱。
由於環境二噁英類主要以混合物的形式存在,在對二噁英類的毒性進行評價時,國際上常把各同類物折算成相當於2,3,7,8-TCDD的量來表示,稱為毒性當量(Toxic Equivalent Quantity,簡稱TEQ)。為此引入毒性當量因子(Toxic Equivalency Factor,簡稱TEF)的概念,即將某PCDDs/PCDFs的毒性與2,3,7,8-TCDD的毒性相比得到的係數。樣品中某PCDDs或PCDFs的質量濃度或質量分數與其毒性當量因子TEF的乘積,即為其毒性當量(TEQ)質量濃度或質量分數。而樣品的毒性大小就等於樣品中各同類物TEQ的總和。TEQ的計算公式如下:
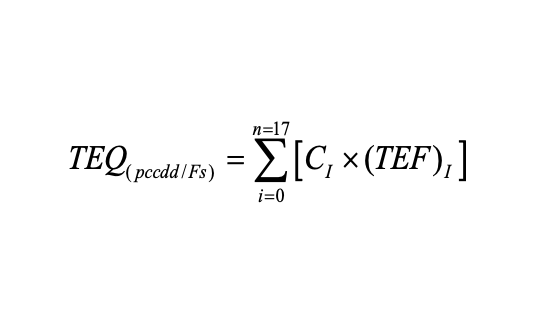
式中,Ci為第i種2,3,7,8-氯取代二嗯英的濃度n或ng;TEF為第i種2,3,7,8-氯取代二嗯英的毒性當量因子。
2,3,7,8-四氯代二苯並對二噁英毒性
作為二噁英中毒性最強的衍生物之一,2,3,7,8-四氯二苯並對二噁英(TCDD)是一種無色至白色結晶固體。它沒有已知的商業套用,但它被用作研究化學品。經過測試它可作為防火劑和殺蟲劑破壞木材的真菌,但從未在商業上使用。 TCDD作為氯苯氧基除草劑中的污染物出現,包括2,4,5-三氯苯氧乙酸(2,4,5-T)),在1960年和1970年廣泛用於控制雜草(包括控制牧場和糧食作物上的雜草)和越南戰爭期間的落葉劑。
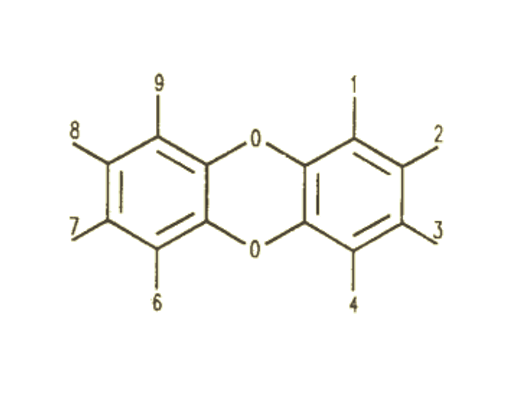
2,3,7,8-四氯代二苯結構式
人體暴露和毒性:與人類TCDD暴露相關的最常報告的症狀是氯痤瘡。皮膚痤瘡樣病變可能在暴露後幾周發展,並可能在停止暴露後持續一年以上。其他皮膚問題包括色素沉著過度、多毛症、皮膚脆弱性增加和皮膚暴露部位的水皰疹。在一組243名暴露於TCDD的產業工人中檢查了癌症發病率和特定原因死亡率。發現,自首次暴露以來,TCDD劑量較高,間隔時間較長,特別是消化道癌和呼吸道癌,癌症風險比增加。在高劑量組中,首次接觸後20年的總癌症死亡率增加,呼吸道癌症也是如此。這項研究提供了TCDD累積劑量與整體癌和消化道癌發生之間關係的進一步證據。沒有發現TCDD對循環系統疾病引起的總死亡率或死亡有影響的證據,迄今為止也沒有發現非霍奇金淋巴瘤或軟組織肉瘤的病例。
動物研究:測試了TCDD在兔耳中產生氯痤瘡的效力。誘導病變的閾值水平在純化合物的1 ug和化合物吸附到木炭上的160 ug之間。化學甲狀腺切除術在給予100 ug TCDD/kg後45天內有效保護了athyroid大鼠免於死亡,而70-80 %的非甲狀腺切除-甲狀腺功能正常和甲狀腺切除-T4(甲狀腺素)維持的功能正常大鼠在同一時間段內死亡。這些數據表明,甲狀腺激素在甲狀腺介導TCDD毒性中起重要作用。為了測試TCDD作為肝癌發生啟動子的潛力,在部分肝切除術後接受單次10 mg/kg劑量的二乙基亞硝胺的大鼠給予TCDD(每2周一次0.14和1.4 ug/kg sc)7個月。接受(a)部分肝切除術後僅接受單次起始劑量的二乙基亞硝胺且未進一步治療或(b)單獨接受TCDD而不接受二乙基亞硝胺的動物表現出相對較少的酶改變病灶和肝細胞癌。然而,以二乙基亞硝胺開始然後給予TCDD的動物的酶改變病灶顯著增加。在較高劑量的TCDD下,七隻大鼠中有五隻存在肝細胞癌。酶改變病灶所占據的肝臟總體積,但不是其數量,隨著二乙基亞硝胺加部分肝切除術後給予的TCDD劑量而增加。TCDD在幾種體外和體內短期試驗中的任何一種中都沒有誘變性。鼠傷寒沙門氏菌株TA98、TA100、TA1535、或暴露於TCDD的TA1537,有或沒有S9活化酶。在有或沒有S9激活的L5178Y tk+/-小鼠淋巴瘤細胞中未觀察到三氟胸苷抗性(基因突變)的誘導。生態毒性研究:TCDD對水生生物有毒。青鱂魚(Oryzias latipes)浸泡在TCDD處理過的水中28天,然後在清水中浸泡長達8個月,導致多個部位的腫瘤增加,包括鰓,甲狀腺和魚膀胱。在暴露於TCDD10天后存活的孔雀魚顯示出上頜軟骨和鰭壞死。
毒性數據:LD50:201微克/公斤(口服,大鼠)(T26) LD50:120微克/千克(腹膜內,小鼠)(T14),
最低風險水平:急性口服:0.0002微克/千克/天(L13) 中級口服:0.00002微克/公斤/天(L134) 慢性口服:0.000001微克/千克/天(L134)
毒性作用
關於二噁英類致癌毒性的首次文獻報導是1978年Kociba發表的雌性SD(Sprague-Dawley)大鼠2,3,7,8-TCDD慢性生物試驗報導。基於這一重要發現,在以後20多年裡關於二噁英類對人體的潛在致癌風險性問題的研究受到科學界的廣泛關注。當時報導的2,3,7,8TCDD致癌性不可見有害作用水平(no oberserved adverse effect level,NOAEL)為1 ng/(kg·d)。但根據1990年的組織病理學診斷標準重新審定當年的病理組織學切片時發現,有2/3曾被診斷為肝癌的組織病變程度未達到癌變水平,再次計算得出的NOAEL值為10 ng/(kg·d)。據此外推得出的人體TCDD致癌毒性特定風險劑量(risk-specific dose, RsD)值比1978年的RsD值下降了至少16倍。因此,美國環境保護局(Environmental Protection Agency, EPA)、WHO、英國食品標準局(U.K. Food Standards Agency)、聯合國糧食及農業組織食品添加劑專家委員會(the Joint FAO/WHO Expert Committee on Food Additives, JECFA)一致認為,雖然2,3,7,8-TCDD是人體強致癌物,但就目前人類二噁英類暴露實際背景值狀況而言,非致癌毒性作用(noncarcinogenic effect)比致癌毒性作用(carcinogenicity)對人體健康危害的風險更大。此外,二噁英類具有結構穩定、半衰期長的特性,僅需暴露一次就可長期留存體內,長期接觸可造成體內蓄積。因此,低劑量的長期接觸也會造成嚴重的機體毒害作用。
分子毒性作用機制
二噁英類高度脂溶性的特點使其極易透過細胞膜進入細胞漿,在胞漿內作為配體與轉錄因子芳香烴受體(aryl hydrocarbon receptor, AhR)結合後,以與固醇類激素的相似作用機制發揮毒性作用。AhR與TCDD結合後被激活,分別與先前結合的4個配體脫離,即兩個熱休克蛋白亞基(HSP90)、p23和B型肝炎病毒X相關蛋白(XAP2/AIP/Ara9).TCDD-AhR複合物在細胞核內與芳香烴受體核轉位子蛋白(Ah receptor nuclear translocator protein, ARNT)結合後獲得與DNA結合的能力。此時AhR/ARNT異源二聚體能夠識別TCDD反應基因上游部位的特異DNA序列——異型生物質/二噁英類/芳香烴受體反應元件(xenobiotic/dioxin/aryl hydrocarbon receptor response elements, XRE/DRE/AhRE),與之結合後可啟動下游靶基因的轉錄,誘導產生多種毒性效應。下游靶基因中最重要的是細胞色素P450酶系基因族中CYP1A1基因,其次是谷胱甘肽-S-轉移酶Ya基因(glutathione S-transferase Ya, GSTYa)。最近研究發現,芳香烴受體抑制因子(aryl hydrocarbon receptor repressor, AhRR)作為另一個重要靶基因也被TCDD激活AhRR與AhR、ARNT同屬於bHLH/PAS蛋白家族,同樣可以與ARNT形成異源二聚體並與XRE結合,但並不啟動下游基因的轉錄,因此被認為是AhR相關靶基因的體內負相調節因子。另外,一些免疫系統細胞信號傳導因子基因上游亦發現了DRE序列,也屬於AhR/ARNT的下游靶基因,如IFN、TNFβ、IL-1、IL-2、IL-6等。這些細胞因子在轉錄水平可以下調細胞色素P450的表達水平,對抗TCDD的誘導作用。
有報導稱二噁英類暴露後細胞信號轉導通路中的蛋白酪氨酸激酶和cAMP依賴性蛋白激酶被激活,傳遞錯誤的跨膜信息,干擾細胞代謝和正常生命活動。前者參與細胞增值和分化,後者引起細胞內Ca水平增高,對細胞分泌功能加強、糖原代謝途徑和葡萄糖的攝取產生影響,可能與二噁英類引起的代謝廢物綜合症中機體脂肪消耗和進行性衰竭症狀相關。
污染來源
大氣環境中的二噁英來源複雜,鋼鐵冶煉,有色金屬冶煉,汽車尾氣,焚燒生產(包括醫藥廢水焚燒,化工廠的廢物焚燒,生活垃圾焚燒,燃煤電廠等)。含鉛汽油、煤、防腐處理過的木材以及石油產品、各種廢棄物特別是醫療廢棄物在燃燒溫度低於300-400 ℃時容易產生二噁英。聚氯乙烯塑膠、紙張、氯氣以及某些農藥的生產環節、鋼鐵冶煉、催化劑高溫氯氣活化等過程都可向環境中釋放二噁英。二噁英還作為雜質存在於一些農藥產品如五氯酚、2,4,5-T等中。
燒結過程
燒結過程中二噁英的形成機理較為複雜,其主要成分為燒結原料中的氯。燒結過程二噁英的形成根據不同的分類標準可分為多種類型:按溫度可分為低溫和高溫反應;按反應物類型可分為前驅物反應和從頭合成反應。低溫(250~450℃)條件下二噁英主要通過燃燒過程中的多相催化反應形成;高溫(500~800℃)條件下二噁英的形成主要是發生了高溫氣相合成反應。燒結過程中二噁英的形成主要是通過低溫條件下的多相催化反應實現的。以Cu為例:Cu不僅對二噁英形成過程中的芳香化反應有較大的促進作用,還對HCl生成Cl2的反應有較強的催化活,極大的增加Cl源。
垃圾焚燒
目前已被證明的在垃圾焚燒過程中PCDD/Fs的生成機理主要有3種:
1.高溫氣相機理(high temperature gas-phase mechanism),結構相對簡單的短鏈氯化碳氫化合物首先通過縮合和環化作用生成氯苯(CBzs),然後在一定條件下氯苯轉化為多氯聯苯(PCBs),而多氯聯苯(PCBs)在871~982 ℃的溫度範圍內將進一步轉化成PCDFs,而部分生成的PCDFs將進一步生成PCDDs。
2.前體合成機理(precursor synthesis mechanism),在燃燒爐內的不完全燃燒以及燃燒後區域內的飛灰表面的異相催化反應可形成多種有機前體,比如多氯代苯和多氯苯酚,然後這些前體經過在催化媒介的縮合反應中生成PCDD/Fs。
3.從頭合成機理(de novo synthesis mechanism),在燃燒後區域內的飛灰中,含有一些沒有完全燃燒的殘碳,其中可能包括無機碳源(活性炭和炭黑)、有機碳源(脂肪族和芳香族的化合物片段)、羰基和羧基等,飛灰中還含有氯源,其中可能包括無機氯源[氯化氫(HCl)和氯氣(Cl2)]、有機氯源(氯化的脂肪族和芳香族的化合物片段),其中還可能包含有氯化銅(CuCl2)和氯化鐵(FeCl3)及相應的金屬氧化物,這些組分可能在200~400 ℃的範圍內通過異相催化反應生成PCDD/Fs。
另外,電視機不及時清理,電視機內堆積起來的灰塵中,通常也會檢測出溴化二噁英。而且含量較高,平均每克灰塵中,就能檢測出4.1微克溴化二噁英。
儘管二噁英來源於本地,但環境分布是全球性的。世界上幾乎所有媒介上都被發現有二噁英。這些化合物聚積最嚴重的地方是在土壤、沉澱物和食品,特別是乳製品、肉類、魚類和貝殼類食品中。其在植物、水和空氣中的含量非常低。PCB工業廢油的大量儲存,其中許多含有高濃度的PCDFs,這種現象遍及全球。長期儲存以及不當處置這種材料可能導致二噁英泄漏到環境中,導致人類和動物食物污染。PCB廢物很難做到在不污染環境和人類的情況下處理掉。這種材料需要被視為危險廢物並且最好通過高溫焚燒處理。環境中的二噁英可通過食物鏈(如飼料)富積在動物體中,由於高親脂性,二噁英容易存在於動物脂肪和乳汁中。因此,肉、禽、蛋、魚、乳及其製品最易受到污染。另外,在食品加工過程中,加工介質(如溶劑油、傳熱介質等)的異常泄露也可造成加工食品的二噁英的污染。
健康影響
急性致死毒性
2,3,7,8-TCDD被認為是二噁英類中毒性最強的一種,但其急性致死效應LD50在不同種屬試驗動物之間差異極大。如對2,3,7,8-TCDD較敏感的動物豚鼠LD50為0.6 μg/kgBW,而不敏感的倉鼠LD50>3000 μg/kg BW,兩者相差5000倍。2,3,7,8-TCDD急性中毒的動物一般在存活數周后才死亡,在此期間機體表現為“代謝廢物綜合症”,其特徵為食慾下降,染毒幾天之內便出現嚴重的體重下降,並伴隨有肌肉和脂肪組織的急劇減少,體重下降程度與染毒劑量具有劑量-效應關係。但是到目前為止,尚未見到由於人類全身性中毒而死亡的報告。人類暴露的觀測病例報導一是氯痤瘡,二是暫時性肝毒效應。
皮膚毒性
氯痤瘡是二噁英類中毒的特徵性標誌。人體和哺乳動物二噁英類暴露後皮膚都會出現氯痤瘡,其形成具有潛伏期。其機制可能是未分化的皮脂腺細胞在二噁英類毒性作用下化生為鱗狀上皮細胞,致使局部上皮細胞出現過度增殖、角化過度、色素沉著和囊腫等病理變化,可伴有胸腺萎縮和廢物綜合症。臨床見到的人體皮膚氯痤瘡病變與青春期痤瘡非常相似。
肝毒性
由於食物鏈的富集作用,受二噁英類污染的魚類、貝類、肉類、蛋類等脂類含量高的動物性食物可經消化道進入人體,成為人體二噁英類日常暴露的主要途徑。動物毒性試驗多採用口飼、灌胃和腹腔注射作為介導二噁英類進入動物體內的途徑。這些介導途徑使二噁英類進入機體後在肝臟發生首過消除效應,使肝臟較早大量接觸二噁英類並成為其最主要的毒性靶器官。肝臟病變的共同特徵是肝臟體積增大、實質細胞增生與肥大。義大利Seveso化工廠爆炸事故受害者中肝臟功能異常是常見病變之一。
致癌性
2,3,7,8-TCDD對人和動物均具有強致癌性。在常用試驗動物不同種屬中,小鼠的毒性試驗表現最為敏感,致其肝癌的LOAEL最低可達10ng/kgBW。肝臟、甲狀腺、胰腺、前列腺、肺、皮膚、牙齦、硬齶和軟組織等均可成為2,3,7,8-TCDD誘發腫瘤的靶器官。Seveso污染事故後流行病學追蹤調查結果顯示,事故中的暴露者,肝臟、淋巴造血系統、消化道等癌症發病率顯著增高。雖然二噁英類單獨暴露就可誘發細胞癌變,但嚙齒類動物肝臟、肺和皮膚的兩階段致癌模型試驗與體外細胞培養毒性試驗的結果都提示,2,3,7,8-TCDD可能不是一種直接的腫瘤引發劑,而是強促長劑,且未發現有遺傳毒性。因此,1997年WHO國際癌症研究機構(IARC)根據動物試驗和流行病學研究結果將2,3,7,8-TCDD定為對人類一級致癌物。
生殖毒性與內分泌干擾毒性
二噁英類在雌性動物體內表現為抗雌激素效應,可以使大鼠、小鼠、靈長類雌性動物的受孕或坐窩數減少,子宮重量減輕,卵巢卵泡發育和排卵障礙。哺乳動物試驗、體外細胞培養研究和流行病學調查結果均表明,二噁英類慢性暴露還可以導致子宮內膜異位症的發病率上升。發生機制可能與二噁英類誘導CYP1A1高表達後干擾體內雌激素正常代謝、機體免疫系統功能受損以及子宮內膜間質組織基質金屬蛋白酶表達增強有關。
雄性哺乳類動物二噁英類染毒後均可發生睪丸和附睪重量下降、精子數目明顯減少、精子運動能力下降等。流行病學研究顯示男性工人血清二噁英類濃度與睪丸酮水平呈負相關,與促卵泡生成素(FSH)和黃體激素(LH)水平呈正相關。因此,男性人體對二噁英類抗雄性激素作用(雌性化效應)比動物更為敏感。毒性機制可能與二噁英類誘導局部睪丸和附睪精子進入氧化應激(oxidative stress)狀態有關。
二噁英類除了能幹擾體內性激素代謝外,還可以改變體內胰島素、甲狀腺激素的代謝水平。二噁英類可以使動物體內胰島素水平下降,引發糖代謝紊亂。大鼠二噁英類低毒慢性暴露後可以使胰腺組織發生腺泡上皮胞漿空泡增多且呈增殖狀態、慢性活動性炎症、動脈炎等非瘤性病變。胰腺的代謝障礙可能波及到分泌胰島素的胰島組織代謝,引起體內胰島素代謝紊亂。腺泡上皮細胞內CYP1A1、腸促胰酶肽A受體蛋白(CCKAR)、AhR和澱粉酶的表達強度差異提示二噁英類可能直接作用於胰腺組織細胞,干擾細胞代謝和功能引發病變。大鼠二噁英類低毒慢性暴露後在甲狀腺組織可以觀察到可逆性細胞增殖現象,如腺腔與腺泡上皮細胞面積比值下降、細胞增殖周期蛋白表達增強以及凋亡細胞數目增多等。細胞異常可能與二噁英類干擾甲狀腺激素正常代謝有關。越戰期間接觸橙劑的美軍士兵(尤其是噴灑藥物的士兵)以及Seveso污染地區人群中糖尿病的發病率均相對較高。
發育毒性和致畸性
在胚胎期和幼兒期,機體組織細胞在體內多種生物信息因子(如激素和生長因子)的調控下,依次進行著增殖、分化和凋亡等生命過程。各系統組織細胞在這一階段代謝旺盛、遺傳信息表達活躍,對細胞毒性化學物質毒性效應表現為高度敏感。
嚙齒類動物毒性試驗證實孕鼠和幼鼠對二噁英類發育毒性高度敏感,如對小鼠母體無毒性效應的二噁英類低劑量暴露可以導致胎鼠發生齶裂和腎盂積水。斑馬魚胚胎細胞體外培養暴露試驗亦證實二噁英類可以通過AhR2途徑促進細胞CYP1A1表達,干擾水生脊椎生物的胚胎髮育過程。二噁英類的子代生殖系統、神經系統和免疫系統的發育毒性尤其引人關注。大鼠孕期或哺乳期內一次給予低劑量二噁英類就可以導致仔鼠生殖器畸形、精子數減少和卵泡發育異常。孕鼠妊娠期暴露二噁英類可以使仔鼠大腦皮層厚度變薄,神經系統功能障礙和神經行為障礙。孕鼠妊娠期二噁英類暴露後產下的仔鼠,在最後一次暴露19個月後機體免疫系統功能依然表現為抑制狀態。此外,胚胎在不同發育階段以及不同個體對二噁英類的敏感性亦存在差異。
流行病學研究結果顯示孕婦接觸二噁英類容易引起早產、宮內發育遲緩、死胎的發生,且圍產期胎兒血清中TCDD濃度可以比母體高約2倍。曾接觸含二噁英類落葉劑的美軍越戰退伍老兵後代子女中脊柱裂等先天缺陷病的發生率較高。
免疫毒性
動物免疫系統是二噁英類最主要和最敏感的靶器官之一,敏感動物小鼠的免疫功能在小劑量暴露時即可被抑制。免疫毒性表現為胸腺萎縮、體液免疫和細胞免疫功能下降、抗病毒能力降低以及抗體產生能力下降等。其機制可能與體內二噁英類物質長期抑制殺傷性T細胞(CTL)的產生和誘導淋巴細胞凋亡有關。另外,免疫系統細胞信號轉導因子基因也能夠被TCDD激活,其中的一些細胞免疫抑制因子如IL-10、TGF-β的高表達也會影響機體免疫能力。在二噁英類職業暴露後離開工作崗位20年後,機體CTL功能依然可以呈抑制狀態。越戰期間密切接觸橙劑的美軍老兵現在體檢仍發現體記憶體在免疫系統調節功能障礙。
心血管系統、呼吸系統和神經系統毒性
Seveso污染事故發生20多年後,事故中的暴露者慢性心血管系統疾病、慢性阻塞性肺疾病的發病率仍相對較高。大鼠TCDD慢性暴露試驗發現心肌纖維廣泛存在細胞變性,肝臟和卵巢慢性活動性動脈炎均與TCDD存在劑量-效應關係。在對職業暴露二噁英類後發生過氯痤瘡的2,4,5-T(三氯苯氧基乙酸)作業工人20年後的追蹤調查顯示,其睡眠紊亂、外周神經痛和頭痛等神經系統症狀的發病率明顯偏高。
治理方法
由於二噁英的嚴重危害性,世界各國加強了對二噁英的檢測與防治研究,我國從1996年開始,建立了專用實驗室進行二噁英的防治研究。
目前各國常用的污染防治措施主要是:
(1)源頭治理、降低污染。針對二噁英的來源,控制產生渠道,是世界各國普遍採用的防治措施。即:嚴格控制氯酚類殺蟲劑、消毒劑的生產、使用;全面禁止垃圾、農作物秸稈的無序焚燒;生活垃圾焚燒爐要嚴格控制焚燒溫度不低於850℃,煙氣停留時間不小於2小時,氧濃度不低於6%;對工業三廢及紙漿漂白液進行淨化處理;加強汽車尾氣淨化等。
(2)加強二噁英的檢測和食品安全管理。世界各國除對環境中的二噁英進行控制外,對食品中的二噁英含量也規定了限量標準,超過標準,就不能作食品用。因此,制定適宜的限量標準,加強二噁英的檢測預報,是全球環保組織和機構的共同責任。世界衛生組織和聯合國糧農組織食品法典委員會正著手建立食品中二噁英的最大允許限量。
(3)提高人們的自我防範意識。在加強環境污染控制及食品安全管理的同時,要進一步提高人們的食品安全常識和自我防範意識。二噁英主要富集在脂肪和皮膚內,故建議人們食用低脂肪食品,多吃蔬菜、水果、穀物,均衡飲食,多吃瘦肉,少吃肥肉和皮。對懷疑有污染的食品及時送檢,對宣布可能有問題的食品立即停用。而且政府採取措施,保證食品供應系統安全,顯得尤為重要。
控制技術
改善爐內燃燒條件
低一氧化碳燃燒技術,達到完全燃燒狀態,防止可能產生二惡英的有機揮發物的生成。對於爐排爐(馬丁往復爐排,西格斯爐排,“W”型爐排等爐排爐),採用“3T”技術:即控制爐膛溫度,延長氣體在高溫區滯留時間,在高溫區送入二次空氣,充分攪拌混合以增強湍流度。為達到這些目的,在設計爐型或運行時採取如下措施。
(1)設計較大爐膛容積熱強度,焚燒爐與餘熱鍋爐分開,即焚燒內不設定水冷壁管。當垃圾熱值很低時,可用投油助燃等方法來保持爐溫。
(2)設計足夠容積的氣體燃燒區,擴大二次燃燒區。爐排爐設計成瘦高型,設計低而長的後拱,增長氣體流通路徑。
(3)為了使氣體與空氣完全混合,在乾燥帶頂部相應設定二次高溫燃燒空氣進口,加強爐內氣流的擾動,旋轉。
煙氣處理
焚燒爐內生成的PCDD主要以固態形式附著在飛灰表面,設定高效除塵器可以除去大部分的PCDD。另外,在焚燒爐餘熱鍋爐前噴氨,一方面氨與氯的結合能力強於前驅物與氯的結合能力,可以減少前驅物合成的PCDD,另一方面飛灰中的銅等金屬是合成PCDD的催化劑,噴氨可以使金屬失去催化作用,因而減少PCDD的生成。
飛灰中PCDD的處理
如果除塵器所收集的飛灰中所附著的PCDD超標,就必須處理。一般採用高溫熔化處理,高溫熔爐處理溫度在1200~1400℃,PCDD的分解率為99.77 %,換言之,煙塵中的PCDD經熔融處理,已降到處理前的1/500,飛灰經處理達標後方可填埋。
分析技術
二噁英類化合物的分析檢測開始於20世紀後期。隨著樣品製備技術的改進以及色譜、質譜儀器靈敏度和選擇性的提高,檢測限從最初的μg級(10-6)發展到了fg級(10-15),其中從世紀年代中期到年代初期的進步最顯著。由於二噁英類化合物同類物繁多、結構類似、基質干擾和組分色譜峰交叉嚴重、含量低等原因,導致其分離分析非常困難。為了正確評價鄺和的生態環境危險性,首先必須將其從複雜的環境樣品基質中提取出來,並進行純化分離以排除干擾物,進而才能準確定性、定量這些痕量乃至超痕量級的二噁英類化合物。
20世紀90年代以後,檢測手段不斷完善,檢測靈敏度及檢測限都得以大幅度提高,使二噁英類環境污染物的分析檢測研究進入一個新的階段,大大推進環境中二噁英類污染物的防護、控制、降解等方面研究工作的開展。由於同位素稀釋、高分辨氣質聯用多離子檢測法(HRM-HRMs/MID)具有高選擇性、高分辨串及高靈敏度的特點,近年來己經成為國際上公認的二噁英類化合物的標準分析方法。
人們開始使用氣相色譜測定實際樣本中的二噁英類物質,對二噁英的監測獲得了極大的改進。不久又出現了免疫學和生物學的方法。到目前為止,二噁英類化合物質檢測方法的研究主要集中於生物測試方法和色譜分析法。其中,色譜分析法包括低分辨色質聯用儀、高分辨色質聯用儀分析。其餘的方法由於檢測限或特異性等原因在實際中沒有得到廣泛套用。
二噁英中毒事件
1971年,密蘇里州維羅納的一家化工廠,將含有高濃度二噁英的工業廢物廉價轉包給了廢油回收商拉塞爾·布利斯。之後數年間,布利斯把從該工廠獲取的數千加侖的廢物同普通廢油混合在一起用作抑塵劑,先後向密蘇里州的道路、馬場等進行了噴灑。不久,當地居民紛紛出現血液、肝和腎功能異常,頻頻染上多種疾病乃至癌症。據事後調查,這種噴灑劑是密蘇里州受二噁英污染土壤的主要污染源,而這些已知的污染土壤中約有60 %都位於時代海灘。1972年底,美國疾控中心接到舉報後展開調查,確定了罪魁禍首是土壤中的高濃度二噁英。
2011年1月,德國多家農場傳出動物飼料遭二噁英污染的事件,導致德國當局關閉了將近5000家農場,銷毀約10萬顆雞蛋,這次污染事件發生在德國的下薩克森邦,被發現當作飼料添加物的脂肪部分遭到二噁英污染,對飼料廠樣品進行的檢測結果顯示,其二噁英含量超過標準77倍多。衛生人員對這些農場生產的雞蛋進行實驗室檢驗發現,38次檢驗當中,有5次不合格。有訊息稱,大量德國雞蛋疑似受到有毒化學原料二噁英的污染,並且這些雞蛋已經出口至荷蘭。德國農業和消費者保護部門發言人霍爾格·艾爾切拉介紹說,德國北部的一家公司出售了約3000噸受到包含二噁英等工業殘渣污染的脂肪酸。這些脂肪酸是製造雞飼料的主要原料。
2004年12月12日尤先科患病系二噁英中毒。11日,尤先科抵達奧地利首都維也納魯道夫英內豪斯醫院繼續接受治療,該院當天公布檢查結果時說,尤先科的病是二噁英中毒所致,血液中二噁英的含量是正常值的1000倍。2008年12月9日葡萄牙檢疫部門在從愛爾蘭進口的30噸豬肉中檢測出致癌物質二噁英。葡食品安全部門正在回收這批豬肉,並進一步調查這批豬肉受污染情況。據葡萄牙盧薩通訊社報導,位於葡萄牙北部孔迪鎮的科羅德-科斯塔·羅德里格斯公司2008年10月和11月從愛爾蘭進口了30噸豬肉,經抽樣檢測,這批豬肉被二噁英污染。葡萄牙食品安全部門已回收這批豬肉中的21噸。有關負責人佩德羅·皮喬基說,這批進口豬肉可能無法全部回收,因其中一些已經售出。他告誡消費者購買豬肉時注意包裝上標註的原產地。
1999年3月,在比利時突然出現肉雞生長異常,蛋雞少下蛋的現象。一些養雞戶要求保險公司賠償。保險公司也覺得蹊蹺,於是請了一家研究機構化驗雞肉樣品,結果發現雞脂肪中的二噁英超出最高允許量的140倍,而且雞蛋中的二噁英含量也已嚴重超標,而且這一“毒雞事件”還牽連了豬肉、牛肉、牛奶等數以百計的食品,一時間,一場食品安全危機在全比利時,甚至在全球上演。而這起事件的源頭,就是雞的飼料被二噁英嚴重污染。
我國雖然缺乏有說服力的二噁英污染數據,但是根據國外的經驗和有限的數據來看,我國在人體血液、母乳和湖泊底泥中都檢出了二噁英,儘管其濃度水平較低,但也說明了二噁英在我國環境中的存在。含氯農藥、木材防腐劑和除草劑等的生產,特別是我國曾用作對付血吸蟲病的滅釘螺藥物(五氯酚鈉)的生產都會有二噁英副產品生成,它們的生產和使用會使二噁英在不知不覺之中進入環境。五氯酚鈉作為首選的滅釘螺化學藥物在我國使用了幾十年,每年的噴灑量約為6000噸,這必然造成二噁英在噴灑區的沉積。因此,我國具有二噁英污染的潛在可能性。
另外,在我國2021年1月1日起施行的《國家危險廢物名錄》列出的危險廢物中,至少有11類與二噁英直接有關或者在處理過程中可能產生二噁英。例如,H04農藥廢物、H05木材防腐劑廢物、HW10多氯(溴)聯苯類廢物、HW18焚燒處理殘渣等。所以,未來幾年甚至十幾年內,開展二噁英污染調查和控制研究都是非常有意義的。
二噁英類CAS
物質名稱 | 名稱簡寫 | CAS號 |
2,3,7,8-四氯代二苯並對二噁英 | T4CDD | 1746-01-6 |
1,2,3,7,8-五氯代二苯並對二噁英 | P5CDD | 40321-76-4 |
1,2,3,4,7,8-六氯代二苯並對二噁英 | H6CDD | 39227-28-6 |
1,2,3,6,7,8-六氯代二苯並對二噁英 | 57653-85-7 | |
1,2,3,7,8,9-六氯代二苯並對二噁英 | 19408-74-3 | |
1,2,3,4,6,7,8-七氯代二苯並對二噁英 | H7CDD | 35822-46-9 |
八氯代二苯並對二噁英 | O8CDD | 3268-87-9 |
2,3,7,8-四氯代二苯並對呋喃 | T4CDF | 51207-31-9 |
1,2,3,7,8-五氯代二苯並對呋喃 | P5CDF | 57117-41-6 |
2,3,4,7,8-五氯代二苯並對呋喃 | 57117-31-4 | |
1,2,3,4,7,8-六氯代二苯並對呋喃 | H6CDF | 70648-26-9 |
1,2,3,6,7,8-六氯代二苯並對呋喃 | 57117-44-9 | |
1,2,3,7,8,9-六氯代二苯並對呋喃 | 72918-21-9 | |
2,3,4,6,7,8-六氯代二苯並對呋喃 | 60851-34-5 | |
1,2,3,4,6,7,8-七氯代二苯並對呋喃 | H7CDF | 35822-46-9 |
1,2,3,4,7,8,9-七氯代二苯並對呋喃 | 55673-89-7 | |
八氯代二苯並對呋喃 | O8CDF | 39001-02-0 |
標準規定
檢測標準
國家出台了一系列標準對不同環境介質中的二噁英含量進行測定。同時,食品、飼料及塑膠等領域也有相應的二噁英檢測標準出台。各項標準名稱及標準編號如表1及表2所示。
標準名稱 | 標準編號 | 環境介質 |
水質 二噁英類的測定 同位素稀釋高分辨氣相色譜-高分辨質譜法 | HJ 77.1-2008 | 水環境 |
環境空氣和廢氣 二噁英類的測定 同位素稀釋高分辨氣相色譜-高分辨質譜法 | HJ 77.2-2008 | 大氣 |
固體廢物 二噁英類的測定 同位素稀釋高分辨氣相色譜-高分辨質譜法 | HJ 77.3-2008 | 固廢 |
危險廢物(含醫療廢物)焚燒處置設施二噁英排放監測技術規範 | HJ/T 365-2007 | 固廢 |
土壤和沉積物 二噁英類的測定 同位素稀釋高分辨氣相色譜-高分辨質譜法 | HJ 77.4-2008 | 土壤和沉積物 |
土壤、沉積物 二噁英類的測定 同位素稀釋/高分辨氣相色譜-低分辨質譜法 | HJ 650-2013 | 土壤和沉積物 |
標準名稱 | 標準編號 | 介質 |
塑膠製品中二噁英類多氯聯苯的測定 氣相色譜-高分辨磁質譜法 | SNT 2691-2010 | 塑膠 |
塑膠製品中二噁英的測定 氣相色譜-高分辨磁質譜法 | SNT 2692-2010 | 塑膠 |
飼料中二噁英及二噁英類多氯聯苯的測定 同位素稀釋-高分辨氣相色譜/高分辨質譜法 | GB/T 28643-2012 | 飼料 |
食品中二噁英及其類似物毒性當量的測定 | GB 5009.205-2013 | 食品 |
污染控制標準
國家在二噁英減排方面優先選擇控制的六大重點行業包括:廢物焚燒、造紙(有氯漂白)、鋼鐵、再生有色金屬、殯葬(火化機)及化工領域。國家針對這六大行業出台了相關的污染控制標準對二噁英的排放進行控制。標準名稱及標準號如表3所示。
標準名稱 | 標準編號 | 環境介質 |
生活垃圾焚燒污染控制標準 | GB18485-2014 | 大氣 |
危險廢物焚燒污染控制標準 | GB18484-2020 | 大氣 |
水泥窯協同處置固體廢物污染控制標準 | GB 30485-2013 | 大氣 |
製漿造紙工業水污染物排放標準 | GB 3544-2008 | 水環境 |
煉鋼工業大氣污染物排放標準 | GB 28664-2012 | 大氣 |
鋼鐵燒結、球團工業大氣污染物排放標準 | GB 28662-2012 | 大氣 |
再生銅、鋁、鉛、鋅工業污染物排放標準 | GB 31574-2015 | 大氣 |
火葬場大氣污染物排放標準 | GB 13801-2015 | 大氣及水環境 |
合成樹脂工業污染物排放標準 | GB 31572-2015 | 大氣及水環境 |
石油化學工業污染物排放標準 | GB 31571-2015 | 大氣及水環境 |